Chẩn đoán ung thư với kĩ thuật sinh thiết mô (tissue biopsy) là kĩ thuật xâm lấn, do đó yêu cầu bệnh nhân tuân thủ quy trình trước, trong và sau khi lấy mẫu, phải ăn kiêng, thực hiện một vài xét nghiệm dị ứng các chất liên quan và có thể gây đau, chảy máu, biến chứng cho bệnh nhân, và mất nhiều thời gian.
Trong khi đó, kĩ thuật sinh thiết lỏng là kĩ thuật không xâm lấn, lấy mẫu lỏng từ máu, nước tiểu, dịch của bệnh nhân để thực hiện các chẩn đoán và điều trị ung thư
Giới thiệu về DNA tự do của tế bào ung thư
DNA tự do của tế bào ung thư (Circulating tumour DNA, ctDNA) là những đoạn DNA có nguồn gốc từ khối u; chúng di chuyển tự do trong máu, mang những đặc điểm di truyền của khối u sinh ra chúng. Từ những năm 2000 trở lại đây, với sự phát triển của kĩ thuật y sinh, nghiên cứu về ctDNA phát triển mạnh và nó có thể là dấu ấn sinh học (biomarker) quan trọng trong chẩn đoán, tiên lượng và điều trị ung thư.
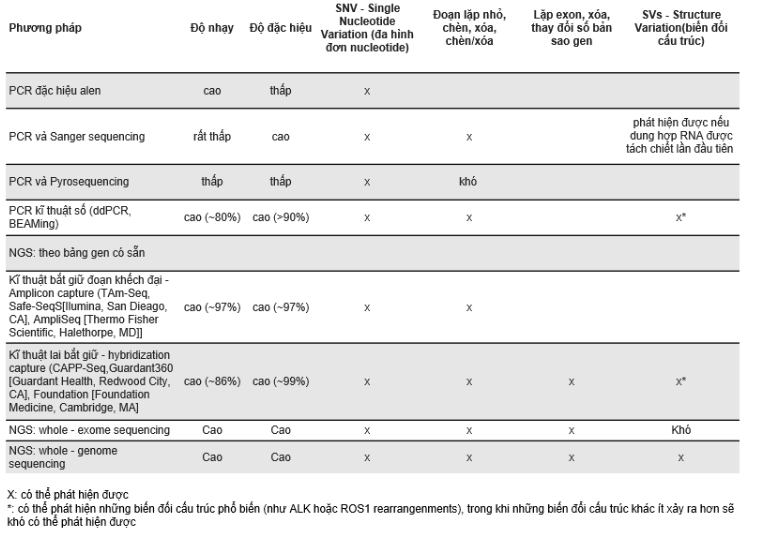
Trong khi đó, kĩ thuật sinh thiết lỏng là kĩ thuật không xâm lấn, lấy mẫu lỏng từ máu, nước tiểu, dịch của bệnh nhân để thực hiện các chẩn đoán và điều trị ung thư [bảng 2]. Hiện nay, hầu hết kĩ thuật sinh thiết lỏng vẫn còn trong giai đoạn nghiên cứu, một số xét nghiệm sinh thiết đã được FDA chấp thuận có thể sử dụng kết hợp với các kĩ thuật khác hỗ trợ sàng lọc ung thư giai đoạn đầu cũng như quá trình điều trị về sau. có thể sử dụng kết hợp với các kĩ thuật khác hỗ trợ sàng lọc ung thư giai đoạn đầu cũng như quá trình điều trị về sau [12]. Nồng độ DNA trong huyết tương có thể từ rất thấp lên tới 100 ng/mL, phần lớn là những đoạn cfDNA phân hủy do các quá trình sinh học của cơ thể như tế bào chết chu trình chết tự nhiên (apoptosis), hoại tử (necrosis). Ở bệnh nhân ung thư, ngoài DNA có nguồn gốc từ những quá trình trên, còn có DNA nguồn gốc từ tế bào ung thư (còn sống, đã chết theo chương trình/hoại tử, tế bào khối u tuần hoàn – circulating tumor cells) chiếm một lượng nhỏ (~10%) trong tổng cfDNA. Các mảnh DNA này có chiều dài khoảng dưới 150bp, ngắn hơn so với các đoạn DNA có nguồn gốc từ tế bào thường (khoảng 160bp). Sự khác biệt về kích thước, vị trí trên hệ gen, các đặc điểm về di truyền ngoại gen (methyl hóa,…) là các đặc điểm quan trọng phát hiện và phân biệt các đoạn DNA từ dòng tế bào tế ung thư so với tế bào thường. Ngoài ra, thời gian tồn tại trong máu của các ctDNA này là khoảng ngắn hơn 2 giờ, do vậy chúng phản ánh chính xác tình trạng tế bào ung thư tại thời điểm lấy mẫu nghiên cứu. Với đặc điểm kích thước ngắn, chỉ chiếm lượng nhỏ trong cfDNA có trong mẫu máu/huyết thanh, việc phát hiện ctDNA bằng kĩ thuật real-time PCR cơ bản hay giải trình tự Sanger tỏ ra không hiệu quả. Với sự phát triển của công nghệ, việc phát hiện ctDNA được cải thiện độ nhạy, độ đặc hiệu và các phân tích về sau cũng được cải thiện. Hiện nay có hai nền tảng công nghệ cơ bản để phát hiện và đánh giá các ctDNA từ mẫu phẩm bao gồm công nghệ PCR và công nghệ giải trình tự gen thế hệ mới NGS (Next Generation Sequencing) [bảng 1]. Thứ nhất, PCR vi giọt kĩ thuật số (droplet digital PCR, ddPCR) và “BEAMing” beads, emulsion, amplification, and magnetics) là hai kĩ thuật được phát triện dựa trên nền tảng của PCR. ddPCR là kĩ thuật sử dụng các giọt vi lỏng (microfluidic) khuếch đại các đoạn DNA bằng mồi huỳnh quang được thiết kế sẵn, hệ thống sẽ đọc tín hiệu kênh màu (tương tự như real-time PCR). BEAMing là kĩ thuật kết hợp khuếch đại DNA bằng PCR nhũ dịch (emulsion PCR) và phân tích kết quả bằng phương pháp đếm tế bào theo dòng chảy (flow cytometry). Thứ hai là công nghệ giải trình tự gen thế hệ mới NGS để khuếch đại lượng lớn các đoạn DNA ngắn có trong mẫu, phân tích và so sánh với các trình tự tham chiếu để phát hiện những biến thể DNA đột biến điểm, đột biến cấu trúc, mức độ methyl hóa,…

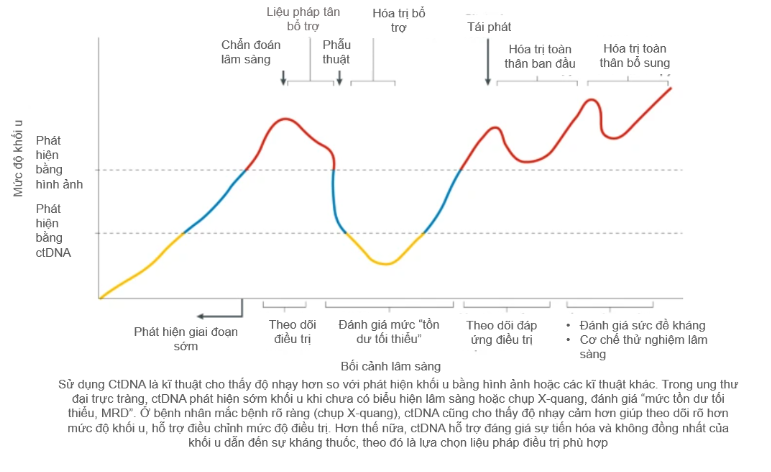
Triển vọng ctDNA ứng dụng trong lâm sàng
Bởi có vai trò quan trọng trong nghiên cứu và điều trị các bệnh lý, đặc biệt là các bệnh ung thư, ctDNA đang là vấn đề nghiên cứu quan tâm của các nhà khoa học, bác sĩ trên toàn thế giới. Năm 2022, Hiệp hội Ung thư Châu Âu đã đưa ra những phân tích, đánh giá, quy chuẩn tham khảo và các khuyến cáo chung liên quan tới ứng dụng sinh thiết lỏng và ctDNA trong các chẩn đoán, tiên lượng và điều trị ung thư [3]. Cũng trong năm 2022, Cục quản lý thực phẩm và dược phẩm Hoa Kì (FDA) đã đưa ra dự thảo hướng dẫn sử dụng ctDNA trong phát triển thuốc sinh học liên quan tới điều trị khối u rắn giai đoạn sớm [4]. Trong nghiên cứu chẩn đoán và điều trị ung thư giai đoạn sớm, ctDNA được nghiên cứu sử đụng để phát hiện biến đổi về gen di truyền, đánh giá nguy cơ thấp/cao, phản ánh ứng của bệnh nhân trong qua trình điều trị,…
Cụ thể hơn, ctDNA được ứng dụng trong nghiên cứu các loại ung thư như ung thư phổi không tế bào nhỏ (non–small-cell lung cancer, NSCLC), ung thư vú (breast cancer), ung thư đại trực tràng (Colorectal cancer), ung thư tuyến tiền liệt (Prostate cancer). Đối với ung thư phổi không tế bào nhỏ, ctDNA dùng sàng lọc đột biến gen EGFR T790M và các đột biến gen khác như ALK, RET, ROS1 hoặc theo dõi gen EGFR KRAS khi điều trị NSCLC bằng liệu pháp ức chế Tyrosine Kinase (Tyrosine Kinase Inhibitor Therapy, TKI) [2]. Trong một nghiên cứu 652 mẫu bệnh nhân ung thư phổi không tế bào nhỏ ở pha IV điều trị “first-line” với thuốc gefitinib trước điều trị cho kết quả đột biến EGFR tương đồng 94,3 % giữa mẫu khối u và mẫu cfDNA, độ nhạy và độ đặc hiệu lần lượt là 65,7 % và 99,8% [9]. Trong khi đó, một nghiên cứu khác khi khảo sát 2453 bệnh nhân ung thư phổi không tế bào nhỏ chỉ ra kết quả độ nhạy của CYFRA 21.1 – dấu ấn sử dụng rộng rãi trong phát hiện/điều trị ung thư phổi không tế bào nhỏ là 78% [8]. Trường hợp khác, bộ sinh phẩm xét nghiệm máu “CancerSEEK” sử dụng kết hợp ctDNA và các protein chỉ dấu sinh học (protein biomarker) đang được nghiên cứu để phát hiện sớm ung thư vú, có độ nhạy 73% ở pha II , 79% ở pha III và độ đặc hiệu 99% [6]. Một kĩ thuật khác là kết hợp PCR và NGS phát hiện số lượng bản sao các biến thể gen (copy number variantion, CNV) ở mẫu ctDNA cũng cho kết quả tốt trong sàng lọc ung thư vú [10].

Những hạn chế và thách thức
Như đã đề cập ở phần đặc điểm của ctDNA, ở thời điểm hiện tại, vẫn còn tồn tại những hạn chế trong các nghiên cứu và chẩn đoán lâm sàng với mẫu sinh thiết lỏng, điều này gây ra nhiều trường hợp chẩn đoán âm tính giả/dương tính giả.
Thứ nhất, nguyên nhân gây ra âm tính giả chủ yếu là do nồng độ ctDNA trong mẫu máu thấp và phụ thuộc vào loại ung thư, mức độ của khối u, trạng thái khối u khi tiến hành lấy máu, …Thêm nữa là hạn chế về số lượng bản sao gen, đặc điểm của biến thể dẫn tới khó phát hiện những biến thể có tần số alen thấp. Chẳng hạn đối với phát hiện biến thể là đột biến nucleotide (single nucleotide variation) hay đoạn xóa/chèn nhỏ cho kết quả tốt, độ nhạy cao, còn đối với những đột biến cấu trúc (dung hợp gen – gene fusion …) cho kết quả độ nhạy kém hơn khi sử dụng kĩ thuật ctDNA.
Thứ hai là dương tính giả gây ra bởi những hạn chế và sai sót khi quá trình phân tích ctDNA bằng công nghệ NGS. Trong quá trình chọn lọc thư viện, xử lí dữ liệu tin sinh học có thể gây ra những chẩn đoán dương tính giả. Tiếp đến là do quá trình phát triển của tế bào, tế bào soma dòng mầm có thể hình thành những biến dị (do điều kiện môi trường, sai sót trong phân chia tế bào,…), những biến dị này được tích lũy, tạo dòng (clonal/subclonal) vô tình có thể mang đặc điểm tương tự với biến dị tồn tại trong khối u cũng sẽ dẫn đến hiện tượng dương tính giả [3,11].
Để khắc phục âm tính giả/dương tính giả cần so sánh kết quả trên mẫu ctDNA và mẫu khối u, nghiên cứu với số lượng đủ lớn, kết hợp nhiều phương pháp khác nhau và đưa ra kết luận phù hợp. Việc tiêu chuẩn hóa điều kiện nghiên cứu là vấn đề cần lưu tâm khác. Sự khác biệt điều kiện nghiên cứu ở phòng thí nghiệm khác nhau dẫn tới các kết quả nghiên cứu khác nhau, cần tham khảo và tối ưu phương pháp để phù hợp với mục đích nghiên cứu, đem lại hiệu quả chẩn đoán và điều trị cho bệnh nhân. Ngoài ra các phương pháp nghiên cứu LB/cfDNA/ctDNA cơ bản đòi hỏi kĩ thuật cao, kiến thức cao về y sinh học vẫn là thách thức đối với các nhà khoa học, nhất là ở những phòng thí nghiệm/cơ sở y tế chưa phát triển.
Chịu trách nhiệm nội dung: Lê Ngọc Thọ – Đại học Khoa học Tự nhiên – Đại học Quốc gia Hà Nội
Góp ý nội dung:
TS Nguyễn Hồng Vũ – Viện nghiên cứu City of Hope, California, Hoa Kỳ
TS Trịnh Vạn Ngữ – Viện ung thư MD Anderson, Hoa Kỳ
BS. Lê Nho Quốc – Khoa Y học hạt nhân, Bệnh viện Chợ Rẫy TP.HCM
Tài liệu tham khảo
- Dasari, A., Morris, V.K., Allegra, C.J. et al. ctDNA application and integration in colorectal cancer: an NCI Colon and Rectal-Anal Task Forces whitepaper. Nat Rev Clin Oncol 17, 757-770 (2020).
- Circulating Tumor DNA in Non–Small-Cell Lung Cancer: A Primer for the Clinician Aditi P. Singh, Haiying Cheng, Xiaoling Guo, Benjamin Levy, and Balazs Halmos JCO Precision Oncology 2017 :1, 1-13.
- https://www.annalsofoncology.org/article/S0923-7534(22)01721-5/fulltext Pascual J., Attard G., Bidard F.-C., Curigliano G., De Mattos-Arruda L., Diehn M., Italiano A., Lindberg J., Merker J., Montagut C., et al. ESMO recommendations on the use of circulating tumor DNA assays for patients with cancer: A report from the ESMO Precision Medicine Working Group. Ann. Oncol. 2022;33:750–768.
- Use of Circulating Tumor DNA for Early Stage Solid Tumor Drug Development Guidance for Industry, FDA (2022).
- Cheng F, Su L, Qian C. Circulating tumor DNA: a promising biomarker in the liquid biopsy of cancer. Oncotarget. 2016 Jul 26;7(30):48832-48841.
- Sant M., Bernat-Peguera A., Felip E., Margelí M. Role of ctDNA in Breast Cancer. Cancers. 2022;14:310.
- Arisi MF, Dotan E, Fernandez SV. Circulating Tumor DNA in Precision Oncology and Its Applications in Colorectal Cancer. Int J Mol Sci. 2022 Apr 18;23(8):4441.
- Pavićević R, Bubanović G, Franjević A, Stancić-Rokotov D, Samardzija M. CYFRA 21-1 in non-small cell lung cancer-standardization and application during diagnosis. Coll Antropol 2008 Jun; 32(2): 485-498.
- Douillard JY, Ostoros G, Cobo M, et al: Gefitinib treatment in EGFR mutated Caucasian NSCLC: Circulating-free tumor DNA as a surrogate for determination of EGFR status. J Thorac Oncol 9:1345-1353, 2014
- Kirkizlar E., Zimmermann B., Constantin T., Swenerton R., Hoang B., Wayham N., Babiarz J.E., Demko Z., Pelham R.J., Kareht S., et al. Detection of Clonal and Subclonal Copy-Number Variants in Cell-Free DNA from Patients with Breast Cancer Using a Massively Multiplexed PCR Methodology. Transl. Oncol. 2015;8:407–416.
- Keller, L., Belloum, Y., Wikman, H. et al. Clinical relevance of blood-based ctDNA analysis: mutation detection and beyond. Br J Cancer 124, 345–358 (2021).
- https://my.clevelandclinic.org/health/diagnostics/23992-liquid-biopsy


