Hiện nay, bệnh nhân đang phải chi trả một số tiền rất lớn cho các đơn thuốc điều trị ung thư, đây là gánh nặng lớn đối với bệnh nhân ung thư và gia đình. Bài viết này trình bày quá trình nghiên cứu phát triển, qua đó nêu ra nguyên nhân khiến giá thành các loại thuốc mới, đặc trị có giá thành rất cao.
Phần 1: Quá trình nghiên cứu phát triển thuốc
Quá trình nghiên cứu là môt quá trình lâu dài, phức tạp. Trung bình để ra đời một thuốc mới tiêu tốn 1 tỷ đô la Mỹ, kéo dài từ 10 đến 15 năm bao gồm nhiều giai đoạn khác nhau. Mỗi quốc gia sử dụng một bộ tiêu chuẩn riêng trong việc quản lý, lưu hành thuốc. Hiện nay, các thuốc đặc trị được lưu hành trên thị trường Việt Nam, đặc biệt các thuốc điều trị ung thư phần lớn được nhập khẩu từ nước ngoài, trong đó phổ biến từ Mỹ.
Bài viết này chúng tôi trình bày bộ tiêu chuẩn về quá trình nghiên cứu thuốc được đăng tải trên website của FDA (Food and Drug Administration) Mỹ. FDA là cơ quan chịu trách nhiệm bảo vệ, thúc đẩy sức khỏe cộng đồng thông qua sự quản lý và giám sát sự an toàn thực phẩm, các sản phẩm thuốc lá, thực phẩm chức năng, đơn thuốc, các thuốc không bán theo đơn, vắc xin, dược phẩm sinh học, truyền máu, các thiết bị dược phẩm, thiết bị phát xạ điện từ (ERED, electromagnetic radiation emitting devices), mỹ phẩm, thực phẩm dành cho động vật, các sản phẩm thú y tại Mỹ.
Quá trình nghiên cứu thuốc phải tuân thủ theo các bước bắt buộc và một trình tự nhất định. Điều này đảm bảo để FDA có đầy đủ thông tin cần thiết cho quá trình kiểm duyệt thuốc trước khi cấp phép và đưa ra thị trường. Quá trình phát triển thuốc có thể chia thành 5 bước cơ bản như sau:
Bước 1: Khám phá thuốc
Bước 2: Nghiên cứu tiền lâm sàng
Bước 3: Nghiên cứu lâm sàng trên người dưới sự giám sát của FDA
Bước 4: FDA đánh giá hồ sơ xin cấp phép để tiến hành sản xuất thuốc mới
Bước 5: FDA giám sát, bảo đảm an toàn sử dụng thuốc sau khi đưa vào thị trường
Toàn bộ quá trình nghiên cứu được tóm lược trong hình vẽ 1 để bạn đọc dễ dàng tham khảo.
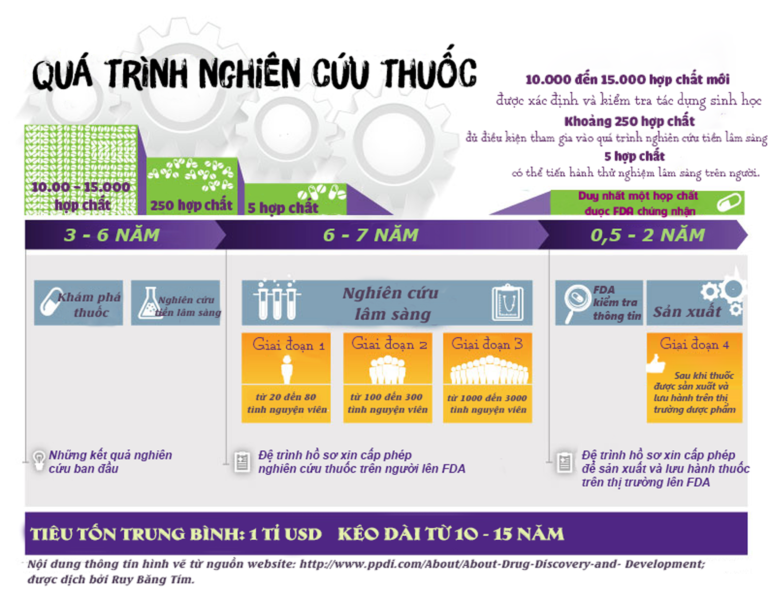
Hình 1: Quá trình nghiên cứu thuốc
Bước 1: Khám phá thuốc
Bước đầu tiên trong quá trình nghiên cứu khám phá thuốc là tìm kiếm hợp chất có hoạt tính sinh học. Đối với thuốc ung thư là các hợp chất có khả năng tiêu diệt tế bào ung thư.
1. Những nghiên cứu về cơ chế sinh bệnh cho phép các nhà khoa học đi sâu nguyên nhân gây bệnh ở cấp độ phân tử. Từ đó, phát triển những hợp chất có khả năng ức chế, chuyển đổi các quá trình gây bệnh.
2. Nguồn dược liệu dân gian là một nguồn nguyên liệu phong phú cho các nghiên cứu phát triển thuốc. Từ những tác dụng điều trị thực tế của các loại dược liệu, các nhà khoa học tiến hành sàng lọc, kiểm tra hoạt tính học của các hàng loạt hợp chất thiên nhiên.
3. Trong quá trình nghiên cứu hay sử dụng thuốc, các nhà nghiên cứu phát hiện ra những tác dụng khác của thuốc. AZT là một ví dụ cho trường hợp này. AZT là một thuốc điều trị HIV được sử dụng phổ biến. AZT được tổng hợp lần đầu tiên vào năm 1964 trong một dự án nghiên cứu thuốc điều trị ung thư. Tuy nhiên, kết quả nghiên cứu không khả quan do vậy, nghiên cứu về AZT bị tạm dừng trong một thời gian dài. Đến năm 1985, các nhà khoa học Viện Nghiên cứu ung thư Hoa Kì (NCI) đã phát hiện AZT có khả năng ức chế vi rút HIV. Một thời gian ngắn sau đó, AZT được đưa vào nghiên cứu lâm sàng trên người. Đến năm 1987, AZT được FDA chứng nhận là một thuốc điều trị HIV(Broder, 2010).
Thông thường, từ hàng ngàn hợp chất tiềm năng chỉ có một số lượng rất ít các hợp chất tiềm năng có thể đáp ứng đầy đủ tiêu chuẩn để tiến hành những nghiên cứu xa hơn.
Bước 2: Nghiên cứu tiền lâm sàng
Trước khi thuốc được thử nghiệm trên người, các nhà nghiên cứu phải làm rõ cơ chế tác dụng của thuốc, đồng thời trả lời câu hỏi thuốc có độc tính hay không. Có hai phương pháp bắt buộc trong nghiên cứu thuốc trong giai đoạn tiền lâm sàng phải được thực hiện: in vitro và in vivo.
In vitro là phương pháp nghiên cứu trên đối tượng là các tế bào, vi sinh vật, phân tử sinh học được nuôi cấy trong phòng thí nghiệm. In vivo là phương pháp nghiên cứu trên đối tượng là các sinh vật sống, trong nghiên cứu thuốc thông thường là động vật như chuột, thỏ…
Mục tiêu của những nghiên cứu này là cung cấp thông tin một cách chi tiết về liều dùng, độc tính, cơ chế tương tác giữa thuốc và tế bào. Tuy nhiên, các câu trả lời này không thể thay thế những nghiên cứu trên cơ thể người. Do đó, giai đoạn tiếp theo thuốc sẽ tiến hành nghiên cứu lâm sàng để xác nhận tác dụng sinh học, cũng như kiểm tra độc tính của thuốc. Nghiên cứu lâm sàng là những nghiên cứu trực tiếp trên cơ thể người.
Bước 3: Nghiên cứu lâm sàng trên người
a. Thiết kế thí nghiệm lâm sàng:
Nhà nghiên cứu thiết kế thí nghiệm lâm sàng cần trả lời các câu hỏi đặc thù liên quan đến nghiên cứu lâm sàng thuốc. Trước khi, các nghiên cứu lâm sàng bắt đầu, các chuyên gia cần đánh giá lại toàn bộ thông tin về thuốc để phát triển bộ câu hỏi nghiên cứu cũng như mục tiêu nghiên cứu. Sau đó, họ sẽ quyết định cách tiến hành thí nghiệm lâm sàng bao gồm các nội dung như người tham gia nghiên cứu, thời gian tiến hành nghiên cứu, các dữ liệu cần tập hợp, phương pháp phân tích số liệu.
b. Giai đoạn tiến hành thử nghiệm lâm sàng trước khi đưa ra thị trường được tiến hành qua ba giai đoạn chính:
1. FDA kiểm định các thông tin trong bộ hồ sơ IND:
Một nhóm kiểm định là các chuyên gia thuộc các lĩnh vực khác nhau có nhiệm vụ kiểm tra toàn bộ thông tin trong bộ hồ sơ IND (Investigational New Drug).
Chứng nhận:
Đội ngũ của FDA có 30 ngày để kiểm tra toàn bộ hồ sơ gốc IND. Quá trình này bảo đảm các tình nguyện viên, những người tham gia vào quá trình thử nghiệm lâm sàng không gặp vấn đề không rõ lý do và nghiêm trọng trong quá trình thử nghiệm lâm sàng. FDA có thể ra quyết định đồng ý các công ty dược phẩm tiến hành nghiên cứu lâm sàng trên người. Đồng thời, FDA cũng có thể yêu cầu hoãn hoặc dừng quá trình nghiên cứu lâm sàng vì một vài lý do sau đây:
• Những người tham gia thử nghiệm có thể gặp phải những rủi ro nguy hiểm hoặc không lý do.
• Người tiến hành điều tra không đáp ứng đầy đủ những tiêu chuẩn cần thiết.
• Hồ sơ IND không có đầy đủ các thông tin về những rủi ro trong thử nghiệm lâm sàng.
• Nguồn nguyên liệu cho quá trình nghiên cứu lâm sàng có sai sót.
2. Tiến hành nghiên cứu lâm sàng
 Hình 2: Quy trình thử nghiệm lâm sàng thuốc trên người.
Hình 2: Quy trình thử nghiệm lâm sàng thuốc trên người.
Giai đoạn 1: Số lượng tham gia từ 20 đến 80 tình nguyện viên, là những người khỏe mạnh hoặc người bị bệnh. Thời gian kéo dài khoảng vài tháng. Mục tiêu là xác định độ an toàn của thuốc, cũng như liều dùng thích hợp. Ước tính có khoảng 70% thuốc được đánh giá có thể vượt qua giai đoạn này, để tiến hành giai đoạn tiếp theo.
Giai đoạn 2: Số lượng tham gia trên vài trăm người bị bệnh. Thời gian kéo dài từ vài tháng đến hai năm. Mục tiêu xác định hiệu quả điều trị cũng như tác dụng của thuốc. Ước tính chỉ khoảng 33% thuốc được đánh giá có thể vượt qua giai đoạn này, để tiến hành nghiên cứu xa hơn.
Giai đoạn 3: Từ 1000 đến 3000 người bệnh tham gia. Kéo dài từ khoảng từ 1 đến 4 năm, Mục tiêu theo dõi hiệu quả điều trị bệnh, cũng như giám sát tác dụng phụ của thuốc đối với số lượng cá thể lớn hơn. Ước tính có khoảng từ 25 đến 30% thuốc có thể tham gia đáp ứng những tiêu chuẩn.
Giai đoạn 4: Vài ngàn người bệnh tham gia. Mục đích đánh giá độ an toàn và hiệu quả của thuốc. Giai đoạn này được tiến hành sau khi thuốc đã đưa vào thị trường. Thông tin được tập hợp từ hiệu quả sử dụng thuốc của người bệnh.
FDA giám sát quá trình nghiên cứu lâm sàng cẩn thận, đưa ra những ý kiến để nâng cao chất lượng, cũng như đảm bảo sự an toàn, các vấn đề đạo đức suốt quá trình nghiên cứu. Toàn bộ tài liệu về quá trình nghiên cứu lâm sàng phải được đệ trình FDA.
Trước khi đệ trình hồ sơ thương mại cấp phép cho một loại thuốc được sản xuất, nhà sản xuất phải có đầy đủ dữ liệu của toàn bộ quá trình nghiên cứu thuốc bao gồm:
1. Quá trình khám phá thuốc
2. Nghiên cứu tiền lâm sàng
3. Thử nghiệm lâm sàng
Bước 4: Đánh giá từ FDA
Các công ty dược cần nộp một bộ hồ sơ xin cấp phép để sản xuất một loại thuốc mới. Bộ hồ sơ này cần đây đủ thông tin khoa học (những nghiên cứu được công bố về loại thuốc đó) chứng minh thuốc thật sự có hiệu quả và an toàn khi sử dụng. Một điểm quan trọng trong bộ hồ sơ cần có số liệu về nghiên cứu lâm sàng, đề xuất về cách dán nhãn thuốc ví dụ: cần đề xuất thuốc sẽ được sản dưới dạng thuốc uống hay thuốc tiêm, hướng dẫn sử dụng thuốc.
FDA nhận hồ sơ xin cấp phép sản xuất một loại thuốc mới (NDA – A New Drug Application). Nếu hồ sơ không hoàn thiện, họ có thể từ chối tiếp nhận hồ sơ. Nếu hồ sơ hoàn thiên, FDA sẽ tiến hành kiểm tất cả các thông tin trong hồ sơ. Hội đồng tư vấn FDA bao gồm các chuyên gia trong lĩnh vực thuốc sẽ tiến hành kiểm tra và đưa ra quyết định một thuốc có thể được sản xuất và lưu hành hay không.
Bước 5: FDA giám sát an toàn sau khi thuốc được bán ra trên thị trường
Mặc dù quá trình phát triển thuốc bao gồm nhiều bước khắt khe tuy nhiên vẫn tồn tại những giới hạn. Thuốc có thật sự an toàn chỉ có thể thật sự được rút ra sau vài tháng thậm chí vài năm sau khi sản phẩm thuốc được lưu hành trên thị trường. Do vậy, FDA vẫn tiếp tục theo dõi các vấn đề liên quan đến việc lưu hành thuốc để đưa ra những hướng dẫn kịp thời trong trường hợp xảy ra những vấn đề không mong muốn.
Các ứng dụng bổ sung
Các nhà phát triển thuốc phải đệ trình hồ sơ ứng dụng bổ sung nếu họ muốn thay đổi quan trọng trong bộ hồ sơ NDA. Thông thường, bất kì thay đổi nào về dạng thuốc, cách dán nhãn, liều dùng phải được chứng nhận bởi FDA.
Giám sát nhà sản xuất
FDA tiến hành giám sát định kì các cơ sở sản xuất thuốc khắp nước Mỹ và bên ngoài nước Mỹ để đảm bảo rằng những người phát triển tuân thủ tốt các tiêu chuẩn sản xuất thuốc. FDA có thể dừng các cơ sở nếu họ không thể đáp ứng những tiêu chuẩn nhỏ.
Quảng cáo thuốc
FDA quy định phương thức quảng cáo đơn thuốc và cách đánh dấu nhãn hiệu. Theo luật, nhà sản xuất thuốc bị nghiêm cấm quảng cảo những cách sử dụng chưa được chứng nhận đối với sản phẩm của họ. Tất cả các quảng cáo như khuyến cáo sử dụng thuốc hay lời nhắc nhở không thể sai lầm hoặc gây hiểu nhầm. Các thông tin này bắt buộc là những thông tin đúng sự thật về hiệu quả sử dụng của thuốc, tác dụng phụ và thông tin về đơn thuốc.
Thuốc tương đương
Thuốc tương đương hay còn gọi là thuốc gốc (generic drug) là thuốc tương đương sinh học với biệt dược gốc về các tính chất dược động học và dược lực học, được sản xuất khi quyền sở hữu công nghiệp của biệt dược đã hết hạn, nhờ đó thường được bán với giá rẻ.
Các thuốc mới được được bảo vệ bản quyền sáng chế một cách nghiêm ngặt. Điều này có nghĩa chỉ duy nhất những công ty Dược phẩm nắm được bản quyền có thể sản xuất và bán ra thị trường. Một khi bằng sáng chế hết hạn, các công ty dược phẩm khác mới có quyền sản xuất.
Tường trình vấn đề
FDA có những quy định cho phép nhà sản xuất, những chuyên gia trong lĩnh vực sức
khỏe và khách hàng tường trình về những vấn đề liên quan đến thuốc đã được chứng nhận.
MedWatch (http://www.fda.gov/Safety/MedWatch/default.htm) là một cổng thông tin để tường trình vấn đề liên quan đến sản phẩm thuốc và các thiết bị y tế. Đồng thời, thông qua website này người dùng có thể biết thêm những thông tin mới về an toàn sử dụng thuốc.
Xem thêm:
Phần 2: Phân biệt thực phẩm chức năng và thành phần bổ sung – ThS Trần Hồng Loan
Phần 3: Sự thật về tác dụng điều trị ung thư của Fucoidan – ThS Trần Hồng Loan
Tài liệu tham khảo
Quy trình nghiên cứu thuốc được đăng tải trên website chính thức của Cục quản lý Dược phẩm Hoa Kì – FDA. https://www.fda.gov/forpatients/approvals/drugs/
http://www.ppdi.com/About/About-Drug-Discovery-and-Development
http://projectaccept.org/supplements-say-required-warning-labels/
Broder, S. (2010). The development of antiretroviral therapy and its impact on the HIV-1/AIDS pandemic. Antiviral Res 85, 1-18.
Chịu trách nhiệm thông tin: Th.S Trần Thị Hồng Loan
Cố vấn khoa học: TS. Nguyễn Hồng Vũ & Th.S Trịnh Vạn Ngữ


