Bài viết này chỉ mang tính chất tham khảo và không thể thay thế ý kiến chuyên khoa của bác sĩ và điều trị viên. Ngoài ra, Ruy Băng Tím cũng muốn nhấn mạnh rằng đa phần giai đoạn đầu ung thư, khi khối u còn cắt bỏ được và ung thư chưa đi căn, việc chữa khỏi bệnh là điều khả thi, vì vậy việc tầm soát định kỳ là vô cùng quan trọng, đặc biệt là ở những người có người thân trong gia đình mắc phải ung thư và nam giới bởi nam giới thường chủ quan và kém thận trọng hơn nữ giới trong việc giữ gìn và kiểm tra sức khoẻ định kỳ.
Những phần khác của chuyên đề:
- Phần 1: Yếu tố nguy cơ và phòng tránh – Nguyễn Cao Luân
- Phần 2: Tầm soát ung thư đại trực tràng – BS Manh Duong
Phân loại giai đoạn ung thư đại trực tràng
Việc phân loại giai đoạn ung thư đóng vai trò thiết yếu trong việc chẩn đoán tiến triển của bệnh và điều trị bệnh bởi mỗi giai đoạn yêu cầu những cách chữa khác nhau.
Bảng phân loại giai đoạn là tỷ lệ sống trong vòng 5 năm
Dựa vào số liệu nghiên cứu được công bố bởi Tạp Chí Ung Bứu Lâm Sàng (1) và Uỷ Ban Liên Tịch Ung Thư của Hoa Kỳ (2)
| Giai đoạn | T (Chỉ số mức độ phát triển khối u gốc) | N (Chỉ số mức độ di căn vào
hạch) |
M (Chỉ số mức độ di căn khu vực khác) | Tỷ lệ sống trong 5 năm tới |
| 0 | Tis | No | Mo | 95,6% |
| I | T1-2 | No | Mo | 96,8-97,4% |
| IIA | T3 | No | Mo | 87,5% |
| IIB | T4a | No | Mo | 79,6% |
| IIC | T4b | No | Mo | 58,4% |
| IIIA | T1-2 | N1-2a | Mo | 68,5-71,1% |
| IIIB | T1-4a | N1-2b | Mo | 53,4-81,7% |
| IIIC | T4a | N2a | Mo | 40,9% |
| T3-T4a | N2b | Mo | 21,8-37,3% | |
| T4b | N1-2 | Mo | 15,7% | |
| IVA | Bất kỳ T nào | Bất kỳ N nào | M1a | chưa đủ số liệu |
| IVB | Bất kỳ T nào | Bất kỳ N nào | M1b | 11.5% |
Giải thích các chỉ số:
Tis: ung thư biểu mô trong ống nghiệm, khối u phát triển ở lớp đệm niêm mạc.
T1: khối u xâm nhập vùng dưới niêm mạc.
T2: khối u xâm nhập cơ đệm niêm mạc.
T3: khối u xâm nhập xuyên qua cơ đệm niêm mạc vào vùng mô tế bào đại trực tràng.
T4a: khối u xâm nhập toàn bộ bề mặt phúc mạc (nội tạng màng bụng).
T4b: khối u xâm nhập trực tiếp hoặc dính chặt vào một cơ quan hay bộ phận nhất định trong cơ thể.
No: không có di căn hạch lân cận
N1: di căn 1-3 hạch
N2: di căn >4 hạch; N2a 4-6 hạch; N2b >7 hạch.
Mo: không có di căn những bộ phận khác
M1a: di căn trong giới hạn một bộ phận hay một vùng nhất định
M1b: di căn màng bụng hoặc hơn 1 bộ phận trong cơ thể.
Hình minh họa cho phân loại giai đoạn (3)
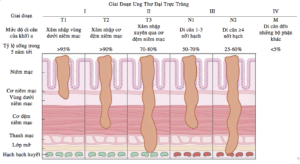

Tuy rằng những số liệu trên có thể thấp hơn ở Việt Nam vì điều kiện trị bệnh chưa cao và phương pháp chữa chưa đa dạng như ở Hoa Kỳ, nhưng dựa vào bảng phân loại trên, có thể dễ dàng quan sát được khuynh hướng chung: giai đoạn đầu khả năng sống khi điều trị sớm là rất cao, trong khi càng về giai đoạn cuối, khả năng sống rất thấp. Vì vậy, Ruy Băng Tím muốn nhấn mạnh thêm một lần nữa việc lưu ý những triệu chứng bất thường trong cơ thể và khám bệnh kịp thời đồng hành với việc tầm soát định kỳ là rất quan trọng.
Tổng quan về phương pháp điều trị
Mục tiêu: Giai đoạn I, II, và III có thể được chữa khỏi bằng phẫu thuật và sau đó loại bỏ những tế bào di căn (4). Ở giai đoạn IV, hầu hết không thể chữa khỏi, nên mục tiêu chính là giảm nhẹ triệu chứng do bệnh ung thư, phòng ngừa những biến chứng và kéo dài thời gian sống nếu có thể (4). Toàn bộ những phương pháp sau được viết theo sát Hướng Dẫn năm 2013 của Mạng Lưới Ung Thư Toàn Diện Quốc Gia Hoa Kỳ (National Comprehensive Cancer Network) và sách Dược Lý: Lối Tiếp Cận Sinh Lý Bệnh Học của DiPiro cùng đồng nghiệp năm 2014 (Pharmacotherapy: a Pathophysiologic Approach).
Giai đoạn khối u có thể cắt bỏ (5)
Phẫu thuật

Cắt bỏ hoàn toàn vùng mô ung thư và hạch (total excision of mesorectum hay viết tắt TME) là phương pháp hiệu quả nhất. Một phương pháp khác là cắt bỏ một phần (laparoscopic colectomy) cũng đang được đón nhận vì điểm mạnh là ít đau đớn hay bị tắc ruột và giảm thời gian nội trú tại bệnh viện hơn phương pháp TME truyền thống. Tuy nhiên, tuỳ vào vị trí và mức độ cắt bỏ, phẫu thuật cũng đi kèm với nhiều nguy cơ khác như viêm nhiễm, tràn dịch hậu môn, tắc ruột, giảm hưng phấn tình dục, và hội chứng suy giảm hấp thụ dinh dưỡng.
Những phương pháp bổ sung khác cũng được sử dụng hậu phẫu với nỗ lực loại bỏ triệt để những tế bào ung thư chưa thể xử lý được bởi phẫu thuật để hạn chế ung thư tái phát và kéo dài thời gian sống. Trong đó xạ trị và hoá trị là 2 phương pháp khá phổ biến.
Hoá/xạ trị bổ sung tiền phẫu
Hoá/xạ trị bổ sung được xem là tiêu chuẩn trong điều trị cho đa phần bệnh nhân ung thư đại trực tràng giai đoạn II. Lợi ích hoá/xạ trị bổ sung tiền phẫu là giảm tái phát, giảm độc tính, và cải thiện hiệu quả của phẫu thuật giữ cơ thắt của đường ruột. Mặt khác, một số bệnh nhân lại không chịu được hoá/xạ trị kéo dài 5-6 tuần liền.
Xạ trị bổ sung hậu phẫu
Xạ trị bổ sung có một vai trò hạn chế trong điều trị hậu phẫu ung thư đại trực tràng và dành cho một nhóm bệnh nhân nhất định. Xạ trị có nhiều tác dụng phụ cấp tính và mãn tính. Triệu chứng cấp tính bao gồm trầm cảm, khó tiểu, tiêu chảy, đau bụng, và viêm ruột thẳng. Các triệu chứng mãn tính đôi khi kéo nhiều tháng sau khi ngưng hoá trị bao gồm tiêu chảy, viêm ruột, tắc nghẽn ruột, đau tầng sinh môn, rối loạn chức năng tình dục và giảm tốc độ lành vết thương.
Hoá trị bổ sung hậu phẫu

Mục đích của hoá trị hậu phẫu là loại bỏ những tế bào ung thư còn sót lại từ phẫu thuật. Những bệnh nhân ở giai đoạn I thường không cần hoá trị bổ sung bởi khoảng 90% bệnh nhân giai đoạn I có thể được chữa khỏi bệnh sau phẫu thuật. Bệnh nhân ở những giai đoạn sau, đặc biệt khi ung thư di căn đến hạch, hoá trị trở nên quan trọng hơn.
Hoá trị theo tiêu chuẩn có chứa hoạt chất fluorouracil hoặc cabecitabine đơn lẻ hay kết hợp với oxaliplatin. Một số phương pháp cũng có bổ sung leucovorin để tăng khả năng gắn kết của chất chuyển hoá fluorouracil với thymidylate synthase (TS) trong tế bào ung thư, từ đó tăng khả năng diệt những tế bào này.
Một tác dụng phụ làm hạn chế liều lượng của fluorouracil là giảm bạch cầu. Những tác dụng phụ khác bao gồm sưng miệng, sưng tay chân, tiêu chảy, buồn nôn và nôn mửa. Trong đó, tình trạng sưng miệng có thể được giảm mạnh nhờ phương pháp áp lạnh miệng – bệnh nhân ngậm viên nước đá nhỏ trong miệng trừ 5 phút trước cho đến 30 phút sau khi tiêm fluororacil.
Những phương pháp kết hợp nhiều hoá trị có thể được dùng trong giai đoạn này:
- FOLFOX4: oxaliplatin, leucovorin, và fluororacil (7)
- mFOLFOX6: oxaliplatin, leucovorin, và fluororacil (cùng thuốc nhưng khác liều lượng so với FOLFOX4) (8)
- FLOX: oxaliplatin, fluorouracil, và folinic acid (9)
- Capecitabine (10)
- CapOx: oxaliplatin và cabecitabine (11)
- Phác đồ điều trị chỉ sử dụng fluorouracil và leucovorin với liều lượng và thời gian khác nhau:
- Phổ biến ở Mỹ: Phác đồ điều trị Roswell Park (12) hoặc Phác đồ điều trị Mayo Clinic (13).
- Phổ biến ở châu Âu: Phác đồ điều trị de Gramont (14).
Mỗi bệnh viện hay tổ chức hay quốc gia khác nhau thường có những cách kết hợp thuốc riêng biệt và còn tuỳ vào phản ứng của mỗi bệnh nhân, nhưng những cách trên tương đối căn bản và phổ biến trên thế giới.
Giai đoạn ung thư di căn (6)
Đa số ung thư ở giai đoạn này không thể chữa được. Ở giai đoạn này, tuỳ vào tình trạng của mỗi bệnh nhân, bác sĩ có thể quyết định phẫu thuật hay không. Tuy nhiên, khả năng sống khá thấp ngay cả khi phẫu thuật và trị liệu hậu phẫu, nhưng những biện pháp này thường làm giảm chất lượng cuộc sống của bệnh nhân. Vì vậy những phương pháp chăm sóc giảm nhẹ với mục đích giảm những triệu chứng gây ra bởi ung thư hay thuốc chữa trị thường được bác sĩ và bệnh nhân quan tâm hơn.
Hoá trị dài hạn cũng có thể kéo dài thời gian sống, tuy nhiên cả bác sĩ, bệnh nhân và người nhà cũng nên cân nhắc việc cân bằng với chất lượng cuộc sống của bệnh nhân đang được chữa trị.
Hoá trị bao gồm những phương pháp kết hợp thuốc tương tự giai đoạn khối u có thể cắt bỏ và thường cộng thêm irinotecan. Irinotecan giúp tăng phản ứng của tế bào ung thư với hoá trị và tăng tỷ lệ sống, nhưng tác dụng phụ là tiêu chảy và giảm bạch cầu nặng nên rất hạn chế trong sử dụng. 2 phương pháp bao gồm irinotecan (15-20):
- FOLFIRI: Fluorouracil, leucovorin và irinotecan
- FOLFOXIRI: Fluorouracil, leucovorin, oxaliplatin, và irinotecan.
Sinh trị bổ sung (biologic therapy)
Sinh trị là phương pháp sử dụng khả năng tự nhiên của cơ thể để thúc đẩy hệ miễn dịch chống lại bệnh tật và ít gây ra tác dụng phụ cho bệnh nhân. Sinh trị được khuyến khích kết hợp với hoá trị được nhắc ở phần trên tăng hiệu quả điều trị ung thư. Đa phần sinh trị vẫn còn khá mới mẻ đối với Việt Nam. Việc sản xuất sinh trị thường rất phức tạp và đòi hỏi khắt khe nên giá thành rất đắt đỏ. Tuy nhiên, đây là một trong những biện pháp mang nhiều hứa hẹn trong điều trị ung thư trong tương lai.
- Bevacizumab (21): Bevacizumab là một kháng thể đơn được nhân bản và tái tổ hợp với khả năng ức chế yếu tố tăng trưởng nội mô mạch máu (vascular endothelial growth factor – VEGF). Kháng thể này được kết hợp với những hoá trị trên để kéo dài thời gian sống cho bệnh nhân.
- Cetuximab (22): Cetuximab có khả năng ức chế thụ thể của yếu tố tăng trưởng biểu bì (epidermal growth factor receptor – EGFR) và được xem là một liệu pháp nhắm trúng đích.
- Panitumumab (23): Panitumumab cùng nhóm với Cetuximab được xử dụng như phương án cuối cùng khi tế bào ung thư đã không còn nhạy cảm với những phương thuốc trên nữa.
- Chất ức chế sự hình thành mạch máu
-
- Ziv-aflibercept (24)
- Regorafenib (25)
Cá nhân hoá phương pháp điều trị
Phương pháp điều trị cho bệnh nhân ung thư đại trực tràng nên được cá nhân hoá dựa vào bản chất của khối u, phản ứng của bệnh nhân, và chỉ thị sinh học (những chất có thể đo lượng được trong một cá thể để phản ánh một hiện tượng cần nghiên cứu như tiến triển bệnh, phản ứng với thuốc…).
- Kiểm tra đột biến gen KRAS (26): Một trong những chỉ thị sinh học quan trọng nhất là đột biến gen KRAS. Sự xuất hiện của KRAS tiên đoán được rằng khối u sẽ phản ứng kém với những nhóm thuốc có tác dụng ức chế EGFR. Kiểm tra KRAS được khuyên áp dụng cho bệnh nhân giai đoạn IV.
- High-frequency microsatellite instability (MSI-H) (26): MSI-H được dịch nôm na là sự bất ổn định của đoạn lập gene với tần số cao, giúp ước lượng được sự cải thiện tiên lượng trong bệnh ung thư đại trực tràng. Kiểm tra MSI-H được khuyên áp dụng cho bệnh nhân giai đoạn II.
Kết quả từ kiểm tra KRAS và MSI-H có thể định hướng được phương pháp chữa trị phù hợp cho từng bệnh nhân. Hiện tại, những nước phát triển, đặc biệt là Mỹ, đã có rất nhiều phương pháp kiểm tra gen tương tự KRAS và MSI-H nhưng độ đáng tin cậy vẫn còn đang được nghiên cứu như biểu hiện TS, TFAP2E, đột biến P53, đồng hợp tử gen UGT1A1 7-lập lại (UGT1A1*28), thiếu hụt DPD, đoạn cắt bỏ sửa chửa bổ sung C1 (ERCC1), MTHFR đa hình…
Vì tính phức tạp của từng loại thuốc, phương pháp chữa trị và cách kiểm tra gen cùng với nhiều nghiên cứu đang tiếp diễn, Ruy Băng Tím sẽ cập nhật và viết rõ hơn ở những bài viết sau.
Đánh giá kết quả điều trị (4)
Trong quá trình điều trị bệnh, bệnh nhân thường được giám sát phản ứng của khối u, tiến triển bệnh và di căn mới. Các xét nghiệm này có thể bao gồm quét ngực CT, chụp X quang, chụp CT bụng hay vùng chậu tuỳ thuộc vào vị trí bệnh đang được đánh giá. Bên cạnh đó, chỉ số huyết học được thu thập đầy đủ trước mỗi đợt hoá trị để đảm bảo tình trạng huyết đủ ổn định. Ngoài ra, còn có những xét nghiệm chức năng gan và thận cơ bản cũng có thể sẽ được tiến hành định kỳ.
Còn những bệnh nhân đã qua phẫu thuật cắt bỏ được khuyên nội soi ruột mỗi 3 năm nếu không phát hiện khối u lành (polyp) mới nào.
Bên cạnh những phương pháp theo dõi và đánh giá trên, bệnh nhân ở mọi giai đoạn hay những người có nguy cơ phát bệnh cao (vui lòng xem thêm Phần 1: Yếu tố nguy cơ và phòng tránh) cần phải có kế hoạch chăm sóc bản thân kỹ lưỡng: đảm bảo tiêm chủng đầy đủ, từ bỏ hút thuốc, giữ cân nặng vừa phải, chế độ dinh dưỡng cân bằng kèm theo lối sống lành mạnh.
Tổng kết
Tuy rằng những khả năng khỏi bệnh và khả năng sống có thể thấp hơn ở Việt Nam so với những nước phát triển vì điều kiện trị bệnh chưa cao và phương pháp chữa chưa đa dạng, nhưng có thể dễ dàng quan sát được khuynh hướng chung: giai đoạn đầu khả năng sống khi điều trị sớm là rất cao, trong khi càng về giai đoạn cuối, khả năng sống rất thấp. Vì vậy, Ruy Băng Tím muốn nhấn mạnh việc lưu ý những triệu chứng bất thường trong cơ thể và khám bệnh kịp thời đồng hành với việc tầm soát định kỳ là rất quan trọng.
Ở những giai đoạn đầu, khi khối u vẫn còn có thể được cắt bỏ, cách chữa trị thường bao gồm phẫu thuật cắt bỏ hoàn toàn hoặc cắt bỏ một phần kèm với xạ trị/hoá trị bổ sung. Hoá trị theo tiêu chuẩn có chứa hoạt chất fluorouracil hoặc cabecitabine đơn lẻ hay kết hợp với oxaliplatin. Một số phương pháp cũng có bổ sung leucovorin. Cũng nên lưu ý rằng mỗi bệnh viện hay tổ chức hay quốc gia khác nhau thường có những cách kết hợp thuốc riêng biệt và còn tuỳ vào phản ứng của mỗi bệnh nhân.
Ở giai đoạn ung thư di căn, tuỳ vào tình trạng của mỗi bệnh nhân, bác sĩ có thể quyết định phẫu thuật hay không. Tuy nhiên, khả năng sống khá thấp ngay cả khi phẫu thuật và trị liệu hậu phẫu, nhưng những biện pháp này thường làm giảm chất lượng cuộc sống của bệnh nhân. Nếu quyết định theo hướng dùng hoá trị, hoá trị có thể bao gồm những phương pháp kết hợp thuốc tương tự giai đoạn khối u có thể cắt bỏ và thường cộng thêm irinotecan, sinh trị…
Những phần khác của chuyên đề:
- Phần 1: Yếu tố nguy cơ và phòng tránh – Nguyễn Cao Luân
- Phần 2: Tầm soát ung thư đại trực tràng – BS Manh Duong
Chịu trách nhiệm nội dung: Tee Nguyễn
Cố vấn khoa học: Tiến sĩ Nguyễn Hồng Vũ, Viện nghiên cứu City of Hope, California, USA.
Lần cuối xem xét khoa học: 15/03/2017
Lần cuối chỉnh sửa: 15/03/2017
Nguồn
- Gunderson LL, Jessup JM, Sargent DJ, Greene FL, Stewart AK. Revised TN categorization for colon cancer based on national survival outcomes data. J Clin Oncol, 2010. 28: p. 264–271. [PubMed: 19949014]
- Colon and rectum. In: Edge SB, Byrd DR, Compton CC, et al., eds.; American Joint Committee on Cancer. AJCC Cancer Staging Manual, 7th ed. New York: Springer, 2010. p. 143–159.
- Kasper D, Fauci A, Hauser S, Longo D, Jameson JL, Loscalzo J. Harrison’s Principles of Internal Medicine. McGraw-Hill Education/Medical, 19th ed. 2015. Available from: http://clinicalgate.com/pancreatic-cancer-2/
- Davis LE, Sun W, Medina PJ. Chapter 107. Colorectal Cancer. In: DiPiro JT, Talbert RL, Yee GC, Matzke GR, Wells BG, Posey L. eds. Pharmacotherapy: A Pathophysiologic Approach, 9e. New York, NY: McGraw-Hill; 2014. Available from: <http://accesspharmacy.mhmedical.com.offcampus.lib.washington.edu/content.aspx?bookid=689&Sectionid=48811502. Accessed September 01, 2016.>
- Benson AB, Bekaii-Saab T, Chan E, et. al. NCCN Guidelines – Localized Colon Cancer v.3.2013. Journal of the National Comprehensive Cancer Network, 2013. 11(5): p. 519-528.
- Benson AB, Bekaii-Saab T, Chan E, et. al. NCCN Guidelines – Metastatic Colon Cancer v.3.2013. Journal of the National Comprehensive Cancer Network, 2013. 11(2): p. 141-152
- Giantonio BJ, Catalano PJ, Meropol NJ, et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: Results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol, 2007. 25: p. 1539–1544. [PubMed: 17442997]
- Andre T, Boni C, Navarro M, et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol, 2009. 27: p. 3109–3116. [PubMed: 19451431]
- Yothers G, O’Connell MJ, Allegra CJ, et al. Oxaliplatin as adjuvant therapy for colon cancer: Updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol, 2011. 29: p. 3768–3774. [PubMed: 21859995]
- Twelves C, Scheithauer W, McKendrick J, et al. Capecitabine versus 5-fluorouracil/folinic acid as adjuvant therapy for stage III colon cancer: Final results from the X-ACT trial with analysis by age and preliminary evidence of a pharmacodynamic marker of efficacy. Ann Oncol, 2012. 23: p. 1190–1197.
- Haller DG, Tabernero J, Maroun J, et al. Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage III colon cancer. J Clin Oncol, 2011. 29: p. 1465–1471. [PubMed: 21383294]
- Wolmark N, Rockette H, Fisher B, et al. The benefit of leucovorin-modulated fluorouracil as postoperative adjuvant therapy for primary colon cancer: Results from National Surgical Adjuvant Breast and Bowel Project protocol C-03. J Clin Oncol, 1993. 11: p. 1879–1887. [PubMed: 8410113]
- O’Connell MJ, Mailliard JA, Kahn MJ, et al. Controlled trial offluorouracil and low-dose leucovorin given for 6 months as postoperative adjuvant therapy for colon cancer. J Clin Oncol, 1997. 15: p. 246–250. [PubMed: 8996149]
- Van Cutsem E, Labianca R, Bodoky G, et al. Randomized phase III trial comparing biweekly infusional fluorouracil/leucovorin alone or with irinotecan in the adjuvant treatment of stage III colon cancer: PETACC-3. J Clin Oncol, 2009. 27: p. 3117–3125.
- Schwarz RE, Berlin JD, Lenz HJ. Systemic cytotoxic and biological therapies of colorectal liver metastases: expert consensus statement. HPB (Oxford), 2013.15: p. 106–115. [PubMed: 23297721]
- Hochster HS, Hart LL, Ramanathan RK, et al. Safety and efficacy of oxaliplatin and fluoropyrimidine regimens with or without bevacizumab as first-line treatment of metastatic colorectal cancer: Results of the TREE studyS. J Clin Oncol, 2008. 26: p. 3523–3529. [PubMed: 18640933]
- Tournigand C, Andre T, Achille E, et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: A randomized GERCOR study. J Clin Oncol, 2004. 22: p. 229–237. [PubMed: 14657227]
- Masi G, Vasile E, Loupakis F, et al. Randomized trial of two induction chemotherapy regimens in metastatic colorectal cancer: An updated analysis. J Natl Cancer Inst, 2011. 103: p. 21–30. [PubMed: 21123833]
- Ducreux M, Malka D, Mendiboure J, et al. Sequential versus combination chemotherapy for the treatment of advanced colorectal cancer (FFCD 2000-05): An open-label, randomised, phase 3 trial. Lancet Oncol, 2011. 12: p. 1032–1044. [PubMed: 21903473]
- Twelves C. Capecitabine as first-line treatment in colorectal cancer. Eur J Cancer, 2002. 38: p. 15–20. [PubMed: 11841931]
- Glimelius B, Cavalli-Björkman N. Metastatic colorectal cancer: current treatment and future options for improved survival. Scand J Gastroenterol, 2012. 47: p. 296–314. [PubMed: 22242568]
- Martín-Martorell P, Roselló S, Rodríguez-Braun E, et al. Biweeklycetuximab and irinotecan in advanced colorectal cancer patients progressing after at least one previous line of chemotherapy: Results of a phase II single institution trial. Br J Cancer, 2008. 99: p. 455–458. [PubMed: 24406735]
- Van Cutsem E, Peeters M, Siena S, et al. Open-label phase III trial ofpanitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol, 2007. 25: p. 1658–1664.
- Van Cutsem E, Tabernero J, Lakomy R, et al. Addition of afliberceptto fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol, 2012. 30: p. 3499–3506.
- Grothey A, Van Cutsem E, Sobrero A. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet, 2013. 381: p. 303–312. [PubMed: 23177514]
- Cunningham D, Atkin W, Lenz HJ, et al. Colorectal cancer. Lancet, 2010. 375: p. 1030–1047. [PubMed: 20304247]



