GIỚI THIỆU
Trong vài năm gần đây, các thông tin quảng cáo về tầm soát ung thư bằng giải trình tự gen NGS được quảng bá rộng rãi. Bài viết này sẽ cung cấp cho bạn đọc những thông tin khoa học để làm rõ những vấn đề sau:- Giải trình tự gen hay giải trình tự gen thế hệ mới là gì?
- Khả năng ứng dụng trong y học, đặc biệt là trong tầm soát ung thư và điều trị ung thư như thế nào!
- Và quan trọng nhất bài viết sẽ cho biết ai là người nên sử dụng giải trình tự trong tầm soát và điều trị ung thư.
1.Giải trình tự gen là gì?
1.1 Bộ gen
Cơ thể chúng ta được hình thành từ các tế bào, các tế bào thì được lập trình sẵn nhờ các gen, gen là một đoạn trình tự DNA hay RNA có chức năng di truyền nhất định. DNA được hình thành từ các đơn vị gọi là nucleotide, mỗi đơn vị này được cấu tạo bởi: một gốc đường năm cacbon, một nhóm phosphat và một trong bốn gốc base adenine, cytosine, guanine, và thymine (trong RNA là uracil) . Trình tự DNA được viết tắt bằng các kí hiệu A,T,G,C ( viết tắt từ tên của các gốc base ở trên: adenine, thymine, guanine và cytosine). Toàn bộ các gen trong tế bào (bộ gen) được lưu trữ trong các nhiễm sắc thể nằm trong nhân tế bào.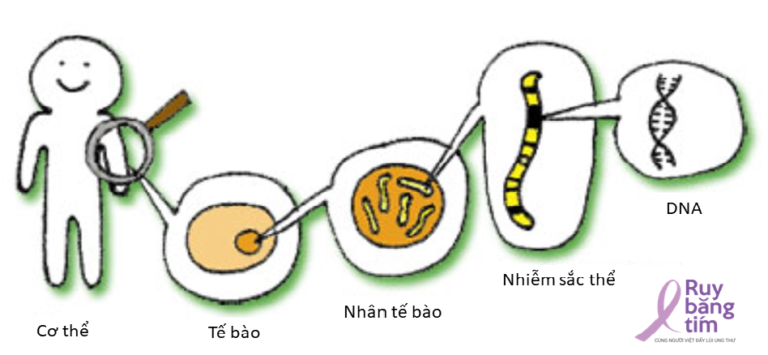
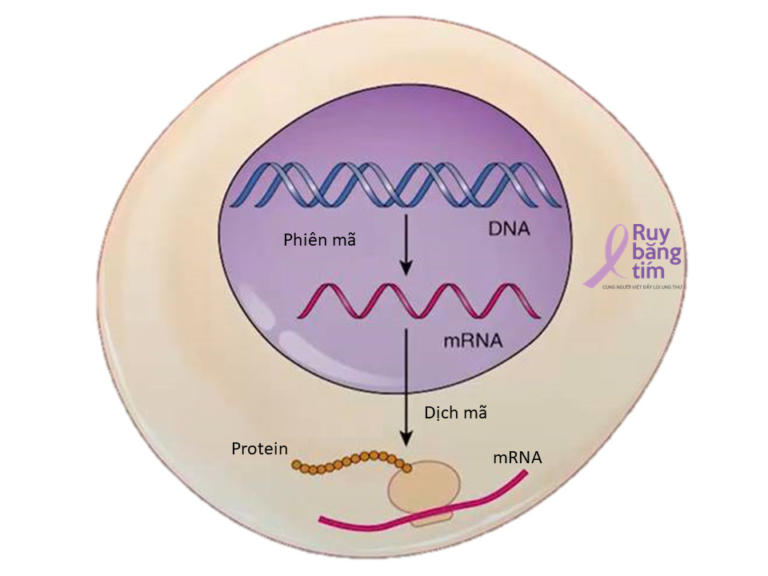
1.2 Giải trình tự gen và giải trình tự gen thế hệ mới là gì
Giải trình tự gen là việc xác định được trình tự DNA của các gen cụ thể Giải trình tự thế hệ mới (NGS –Next generation sequencing), được phát triển trong hai thập kỷ qua cho phép giải mã đồng thời hàng triệu đoạn DNA cùng lúc. Công nghệ tiên tiến này là một cuộc cách mạng thực sự so với các phương pháp giải trình tự truyền thống – giải trình tự Sanger. Trong phương pháp truyền thống một hoặc một vài đoạn DNA tương đối ngắn, được thực hiện giải trình tự cho một số gen duy nhất. Dự án bộ gen người, dựa trên phương pháp giải trình tự truyền thống được đưa ra vào năm 1990, cần 13 năm và hàng tỷ đô la để hoàn thành việc giải trình tự bộ gen của con người hoàn chỉnh. Với NGS, tất cả các gen từ tế bào có thể được giải trình tự cùng một lúc, kết hợp với các siêu máy tính để phân tích, một bộ gen hoàn chỉnh có thể được sắp xếp theo trình tự trong vài ngày với giá ít hơn 1000 đô la cho mỗi bộ gen.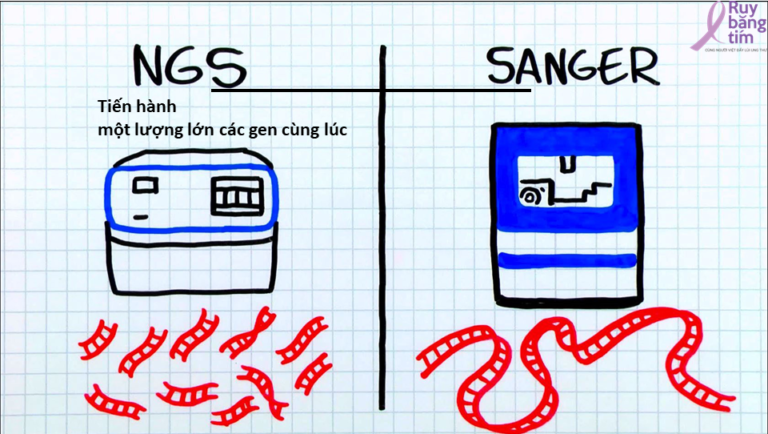
2.Khả năng ứng dụng của NGS trong lâm sàng ung thư
2.1 NGS trong xét nghiệm di truyền, tầm soát các hội chứng ung thư di truyền
Trong tất cả các ca chẩn đoán bệnh ung thư, có khoảng 5% –10% ung thư là do di truyền. Đột biến một số gen nhất định của những người thân trong gia đình cho thấy nguy cơ cao phát triển một số loại ung thư. Xét nghiệm đột biến ở những gen này có vai trò quan trọng trong tư vấn di truyền, giúp gia tăng cơ hội sống sót, tiên lượng bệnh cho những người mang mầm bệnh và xác định liệu pháp điều trị thích hợp nhất và cả các biện pháp phòng ngừa. Xét nghiệm di truyền đã được sử dụng cho bệnh nhân ung thư di truyền trong hơn mười năm ở Mỹ và châu Âu (Xem thêm: https://ruybangtim.com/10-thong-tin-nen-biet-ve-xet-nghiem-gen-trong-ung-thu/). các Các phương pháp truyền thống như hóa mô miễn dịch, FISH xác định một số marker nhất định hay sử dụng PCR và sau đó giải trình tự Sanger giúp kiểm tra các đột biến ở một số gen nhất định đã biết là có liên quan đến ung thư và ung thư di truyền. Tuy nhiên, vì các gen liên quan đến ung thư di truyền là rất lớn và nhiều gen không có điểm đột biến đặc biệt. Do đó sự phát triển giải trình tự gen thế hệ mới (NGS) cung cấp nhiều cơ hội hơn trong xét nghiệm di truyền để phát hiện ra các gen chưa biết nhưng có liên quan đến các loại ung thư nhất định và xác định được cả các biến thể hiếm gặp của nó. Chẳng hạn, ung thư vú và ung thư buồng trứng di truyền (Hereditary Breast and Ovarian Cancer – HBOC) là một trong những hội chứng ung thư phổ biến nhất được nghiên cứu (Xem thêm: https://ruybangtim.com/ban-se-lam-gi-khi-biet-minh-mang-dot-bien-co-kha-nang-cao-se-bi-ung-thu-vu-va-buong-trung/). Các biến thể có tần suất xuất hiện cao của gen BRCA1 và BRCA2 được phát hiện từ năm 1994 đến 1995. Các nghiên cứu di truyền dựa trên việc giải trình tự toàn bộ bộ gen đã giúp xác định thêm các biến thể hiếm gặp có liên quan đến khả năng di truyền ung thư vú. Hơn nữa, vì cho phép kiểm tra nhiều gen cùng một lúc, NGS cải thiện đáng kể tỷ lệ phát hiện, nhiều bệnh nhân ung thư di truyền đã thử nghiệm âm tính với các biến thể di truyền, nhưng với NGS, việc phát hiện và tìm ra nguyên nhân dễ dàng hơn.[2, 3] Hầu hết các xét nghiệm ung thư di truyền bằng NGS sử dụng các bảng gen cố định cho từng loại ung thư nhằm giảm chi phí cho bệnh nhân. Có nhiều loại bảng gen khác nhau, tùy vào số lượng gen và tùy vào loại ung thư; các công ty thực hiện giải trình tự thường có các bảng khác nhau (từ vài gen, đến vài chục gen hoặc hàng trăm gen và giá thành cũng sẽ biến động theo số lượng gen cần phân tích). Giới thiệu một số bảng gen của một số loại ung thư[4-8]:| Loại ung thư | Số lượng gen | Gen |
| Ung thư vú di truyền | 6 | BRCA1, BRCA2, TP53, PTEN, CDH1, STK11 |
| Ung thư vú di truyền | 17 | ATM, BARD1, BRCA1, BRCA2, BRIP1, CDH1, CHEK2, MRE11A, MUTYH, NBN, NF1, PTEN, RAD50, RAD51C, RAD51D, TP53, PALB2 |
| Ung thư đại trực tràng di truyền | 17 | APC, BMPR1A, CDH1, CHEK2, EPCAM, GREM1, MLH1, MSH2, MSH6, MUTYH, PMS2, POLD1, POLE, PTEN, SMAD4, STK11, TP53 |
| Ung thư buồng trứng di truyền | 24 | ATM, BARD1, BRCA1, BRCA2, BRIP1, CDH1, CHEK2, EPCAM, MLH1, MRE11A, MSH2, MSH6, MUTYH, NBN, NF1, PMS2, PTEN, RAD50, RAD51C, RAD51D, STK11, TP53, PALB2, SMARCA4 |
| Ung thư phổi | 11 | EGFR, BRAF, KRAS, NRAS, ALK, ERBB2, MET, ROS1, RET, DDR2, PIK3CA |
2.2. Xác định đột biến ung thư mới bằng NGS
Công nghệ NGS đặc biệt là WES (whole exome sequencing – giải toàn bộ các gen mã hóa: là giải trình tự toàn bộ các gen đã phiên mã và biểu hiện ở mức RNA) và WGS (Whole genome sequencing – giải trình tự toàn bộ bộ gen: là giải trình tự toàn bộ DNA trong tế bào) cho phép phát hiện được các đột biến tế bào dòng sinh dục và các đột biến soma mới, hiếm gặp. NGS đã được sử dụng thành công để xác định đột biến mới trong nhiều loại ung thư, bao gồm ung thư tụy, ung thư bàng quang, ung thư biểu mô tế bào thận, ung thư phổi tế bào nhỏ, ung thư tuyến tiền liệt, bệnh bạch cầu tủy cấp tính, và bệnh bạch cầu lymphocytic mãn tính, và phát hiện các đột biến mới trong những loại ung thư thường gặp như ung thư vú, ung thư đại trực tràng[2]. Chẳng hạn, các nghiên cứu sử dụng WES và WGS đã giúp xác định các gen mới có nguy cơ cao và trung bình trong một số loại ung thư, như gen PALB2 và ATM trong ung thư tuyến tụy, u tuỷ thượng thận di truyền liên quan đến gen MAX, ung thư đại trực tràng di truyền liên quan đến gen POLD1 và POLE hay một số gen mới liên quan đến ung thư vú và buồng trứng di truyền như XRCC2, FANCC và BLM [3].2.3 Phát hiện DNA ung thư trong hệ tuần hoàn bằng NGS
Trong máu các bệnh nhân ung thư thường chứa các tế bào ung thư tuần hoàn (CTC – Circulating tumor cells) và DNA của các tế bào ung thư tuần hoàn (ctDNA – cell free tumor DNA) được hình thành từ khối u nguyên phát hay từ các khối u di căn. Với việc dễ thu nhận CTC và ctDNA thông qua sinh thiết lỏng, giải trình tự từ các mẫu sinh thiết lỏng này là một phương pháp có hiệu quả lớn trong việc chọn lọc các chỉ dấu sinh học (marker) phát hiện ra ung thư và kể cả hỗ trợ giúp đưa ra các quyết định lâm sàng.[2] Các báo cáo đầu tiên chứng minh vai trò của NGS áp dụng trong phân tích di truyền các mẫu sinh thiết lỏng đã được công bố vào năm 2012. Thông qua việc giải trình tự và phân tích ctDNA, Forshew và cộng sự xác định được đột biến ở các gen TP53 và EGFR trong 46 mẫu huyết tương từ bệnh nhân ung thư buồng trứng hoặc ung thư vú. Tương tự, độ nhạy và độ đặc hiệu cao của NGS đã được chứng minh khi sàng lọc 100 huyết tương trên các mẫu bệnh nhân ung thư phổi, kết quả cho thấy đột biến trong năm gen liên quan đến ung thư (EGFR, KRAS, BRAF, ERBB2 và PI3KCA) được phát hiện cả ở ctDNA cũng như trong các mô tổn thương ban đầu. Việc phân tích mẫu sinh thiết lỏng bằng NGS đã được áp dụng cho nhiều loại ung thư như ung thư biểu mô tế bào gan, ung thư vú, ung thư phổi, ung thư đường tiết niệu, khối u đường tiêu hóa và một số loại ung thư khác. Đặc biệt, bằng cách sử dụng phương pháp này không cần sinh thiết xâm lấn từ mô bệnh, kết quả có thể giúp phát hiện sớm, theo dõi đáp ứng với trị liệu, khả năng kháng với điều trị[3]2.4 Dược động học
Từ khi các liệu pháp nhắm mục tiêu được phát triển, các phương pháp đánh giá khối u không chỉ dựa trên hình thái hay đặc điểm miễn dịch tiêu chuẩn của các mẫu khối u mà còn cần đánh giá chi tiết về kiểu gen và các đặc điểm về đột biến. Việc điều trị các khối u rắn khác nhau, ví dụ như ung thư biểu mô tuyến giáp, ung thư phổi, ung thư vú, ung thư đại trực tràng đòi hỏi hiểu biết về tình trạng đột biến trong các gen liên quan đến độ nhạy với thuốc hay khả năng kháng thuốc[9]. Bên cạnh đó, ngày càng nhiều bằng chứng cho thấy sự biến đổi trong các gen mã hóa các enzyme chuyển hóa thuốc hoặc các protein khác trong quá trình chuyển hóa thuốc có liên quan đến khả năng đáp ứng với các loại thuốc điều trị. Các khám phá dược động học dựa trên NGS / WES đã xác định một số biến thể mới có tiềm năng thay đổi hiệu quả điều trị của thuốc, ví dụ như clopidogrel, escitalopram, clozapine và paclitaxel.[3]2.5 Ứng dụng NGS trong liệu pháp trúng đích và điều trị ung thư cá nhân
NGS đã cho phép các nhà nghiên cứu và điều trị sáng tỏ hàng trăm gen liên quan đến ung thư, từ đó giúp phát triển các liệu pháp và đích điều trị mới. Liệu pháp nhắm trúng đích giúp vào một số phân tử có tiềm năng hiệu quả hơn và ít độc hại hơn hóa trị liệu truyền thống cho bệnh nhân bị ung thư. Mỗi bệnh nhân có chứa các đột biến hay các biểu hiện gen khác nhau dù có thể mắc cùng loại ung thư. Việc phát triển các liệu pháp trúng đích và y học cá thể hóa là một trong những đích đến của NGS. Từ kết quả NGS một người xét nghiệm có đặc điểm ít ác tính, ác tính trung bình hay ác tính cao sẽ có liệu trình điều trị khác nhau trong khi với các phương pháp xét nghiệm truyền thống chỉ xác định là âm tính hay dương tính, do đó các bệnh nhân dương tính sẽ được điều trị như nhau. Hơn nữa, khi một bệnh nhân không đáp ứng với một liệu pháp điều trị, từ kết quả NGS có thể tìm ra các loại thuốc hay liệu pháp khác thay thế dựa trên biểu hiện gen hay các thụ thể gen trên từng bệnh nhân.[2]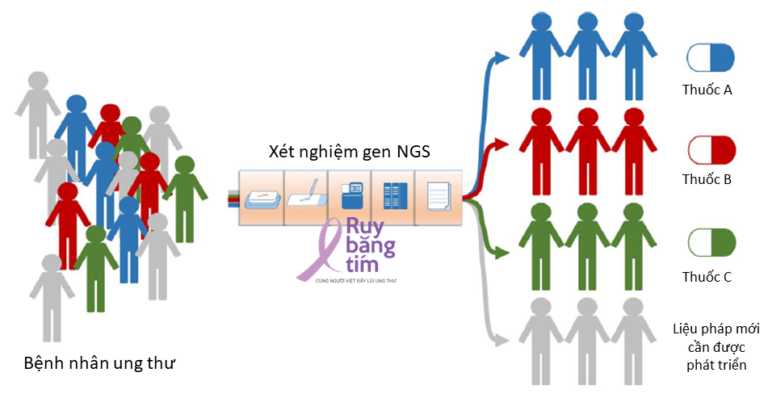
3. Ai nên thực hiện xét nghiệm gen dựa trên NGS
Các phương pháp như sử dụng kỹ thuật realtime PCR ( xác định biểu hiện gen ở mức mRNA) và giải trình tự Sanger đã được FDA Hoa Kỳ chấp thuận trong các xét nghiệm di truyền trước đó. Đến tháng 4/2018 FDA mới có những hướng dẫn chính thức cho việc sử dụng NGS như một phương pháp xét nghiệm di truyền in vitro, tháng 9/2018 FDA chấp thuận xét nghiệm ClonoSEQ dựa trên NGS cho bệnh bạch cầu cấp dòng lympho (ALL) và đa u tủy xương. Trước đó trong năm 2017 một số xét nghiệm dựa trên bảng gen đã được FDA chấp thuận như F1CDx xét nghiệm 324 gen trong các loại ung thư rắn, MSK) IMPACT dùng 468 gene, hay Oncomine Dx Target Test trên 23 gene [11,13,18]. Tuy nhiên cần phải nắm rõ ai là người nên thực hiện xét nghiệm gen: Theo khuyến cáo của Mạng lưới ung thư quốc gia Hoa Kỳ (National Comprehensive Cancer Network), tầm soát ung thư bằng giải trình tự gen NGS xếp vào hàng thứ 2, đứng sau các phương pháp xét nghiệm tiêu chuẩn, trong việc tầm soát cho những người có nguy cơ cao mắc ung thư di truyền, dựa trên tiền sử của bệnh nhân và gia đình[3]. Theo hướng dẫn của Trung tâm dịch vụ phòng ngừa Hoa Kỳ (U.S. Preventive Service) hiện tại chỉ có sàng lọc di truyền ung thư liên quan đến gen BRCA, và theo hướng dẫn này chỉ dành cho phụ nữ có tiền sử cá nhân hoặc gia đình mắc ung thư vú, ung thư buồng trứng, ống dẫn trứng, phúc mạc hoặc tổ tiên liên quan đến đột biến gen BRCA1 /2. Không khuyến cáo cho những trường hợp không có tiền sử bệnh hay gia đình có liên quan đến đột biến gen BRCA1/2[16] Bên cạnh đó trong quá trình điều trị bệnh nhân mắc ung thư, việc xác định hiệu quả của xét nghiệm di truyền hay cụ thể là NGS có ảnh hưởng đến quá trình điều trị không là rất quan trọng. Nếu được xác định là không có ảnh hưởng thì việc tiến hành xét nghiệm gen là không cần thiết. Hiện tại NGS chỉ chỉ định cho những bệnh nhân ung thư mà loại ung thư đó đã xác định được liệu pháp điều trị dựa trên một số các phân tử đích và hiện nay hầu hết chỉ có các bệnh nhân giai đoạn muộn như III/IV được chỉ định làm NGS. Do đó cần lưu ý: Chỉ nên tiến hành khi có chỉ định của bác sĩ [9, 14, 15] Tóm lại, NGS đã được ứng dụng như một phương pháp dùng cho xét nghiệm và ứng dụng trong định hướng điều trị. Tuy nhiên, dù có nhiều ưu điểm, NGS vẫn còn một số hạn chế nhất định và còn cần thời gian để thực sự có thể ứng dụng rộng rãi hơn. Chẳng hạn, một số vùng trên bộ gen khó giải trình tự làm kết quả giải trình tự không chính xác ở những vùng gen này. Ngoài ra, một trong những giới hạn lớn để NGS được đưa vào ứng dụng là giá cả để thực hiện. Chi phí đầu tư về hệ thống máy giải trình tự thế hệ mới, hệ thống siêu máy tính để phục vụ việc giải trình tự cũng như cần có đội ngũ chuyên gia để phân tích kết quả, qua đó làm giá thành mà người bệnh cần chi trả để thực hiện còn khá cao so với các phương pháp truyền thống khác.[17] Hơn nữa, với số lượng lớn các gen ung thư được công bố mỗi năm đã cho thấy nhiều dấu ấn sinh học mới có thể có vai trò quan trọng trong chẩn đoán và điều trị ung thư. Tuy nhiên việc phát triển các dấu ấn sinh học mới cho thấy nhiều hứa hẹn nhưng cũng nhiều các đích phân tử thất bại trong các thử nghiệm lâm sàng và không đủ cho việc ra quyết định lâm sàng. Hiện tại, việc thử nghiệm một loạt các phân tử đích đang ở mức thử nghiệm lâm sàng và chưa được thực hành lâm sàng. Hiện nay việc quảng cáo việc sàng lọc, tầm soát ung thư bằng giải trình tự gen NGS đang bị thổi phồng quá mức và mang lại lợi nhuận cho những đơn vị kinh doanh. Do đó cần hiểu rõ phương pháp tầm soát ung thư bằng giải trình tự gen NGS để sử dụng một cách hiệu quả và tránh các xét nghiệm tốn kém không cần thiết.Tài liệu tham khảo
- Frese, K.S., H.A. Katus, and B. Meder, Next-generation sequencing: from understanding biology to personalized medicine. Biology (Basel), 2013. 2(1): p. 378-98.
- Guan, Y.-F., et al., Application of next-generation sequencing in clinical oncology to advance personalized treatment of cancer. Chinese journal of cancer, 2012. 31(10): p. 463-470.
- Kamps, R., et al., Next-Generation Sequencing in Oncology: Genetic Diagnosis, Risk Prediction and Cancer Classification. Int J Mol Sci, 2017. 18(2).
- Easton, D.F., et al., Gene-Panel Sequencing and the Prediction of Breast-Cancer Risk. New England Journal of Medicine, 2015. 372(23): p. 2243-2257.
- Technologies, L., Ion AmpliSeq™ Colon and Lung Cancer Panel. 2013.
- Dong, L., et al., Clinical Next Generation Sequencing for Precision Medicine in Cancer. Curr Genomics, 2015. 16(4): p. 253-63.
- Institute, Q.D.N., Understanding the Application: NGS Panel Testing for Hereditary Cancer Syndromes and Cancer Targeted Therapy. 2016.
- Laboratory, C.M.D. Colon Cancer Predisposition. 2018; Available from: https://www.ncbi.nlm.nih.gov/gtr/tests/562142/.
- Urszula Demkow, R.P., Clinical Applications for Next-Generation Sequencing. 2015: Academic Press.
- Shen, T., et al., Clinical applications of next generation sequencing in cancer: from panels, to exomes, to genomes. Front Genet, 2015. 6: p. 215.
- Next-Generation Sequencing: FDA Offers Guidance to Streamline Path to Market, https://www.raps.org/news-and-articles/news-articles/2018/4/next-generation-sequencing-fda-offers-guidance-to
- Nagahashi, M., et al., Next generation sequencing-based gene panel tests for the management of solid tumors. Cancer Sci, 2019. 110(1): p. 6-15.
- Luh, F. and Y. Yen, FDA guidance for next generation sequencing-based testing: balancing regulation and innovation in precision medicine. NPJ Genom Med, 2018. 3: p. 28.
- Centers, A.o.C.C. Personalized Medicine and Next Generation Sequencing. 2019; Available from: https://www.accc-cancer.org/home/learn/resource-detail/multidisciplinary-molecular-tumor-boards-two-models.
- Ewalt, M.D., H. West, and D.L. Aisner, Next Generation Sequencing-Testing Multiple Genetic Markers at Once. JAMA Oncol, 2019. 5(7): p. 1076.
- Service, U.S.P., BRCA-Related Cancer: Risk Assessment, Genetic Counseling, and Genetic Testing. 2019.
- Daber, R., S. Sukhadia, and J.J. Morrissette, Understanding the limitations of next generation sequencing informatics, an approach to clinical pipeline validation using artificial data sets. Cancer Genet, 2013. 206(12): p. 441-8.
18.https://www.fda.gov/news-events/press-announcements/fda-authorizes-first-next-generation-sequencing-based-test-detect-very-low-levels-remaining-cancer






