Theo nhiều nghiên cứu gần đây cho thấy, tăng lượng Treg FoxP3⁺ trong vi môi trường khối u (tumor microenvironment) có liên quan tới tiên lượng của bệnh nhân ung thư. Mặc dù còn nhiều tranh cãi về vai trò của Treg, hầu hết bằng chứng đều cho thấy tầm quan trọng của Treg FoxP3+ trong chiến lược điều trị ung thư.
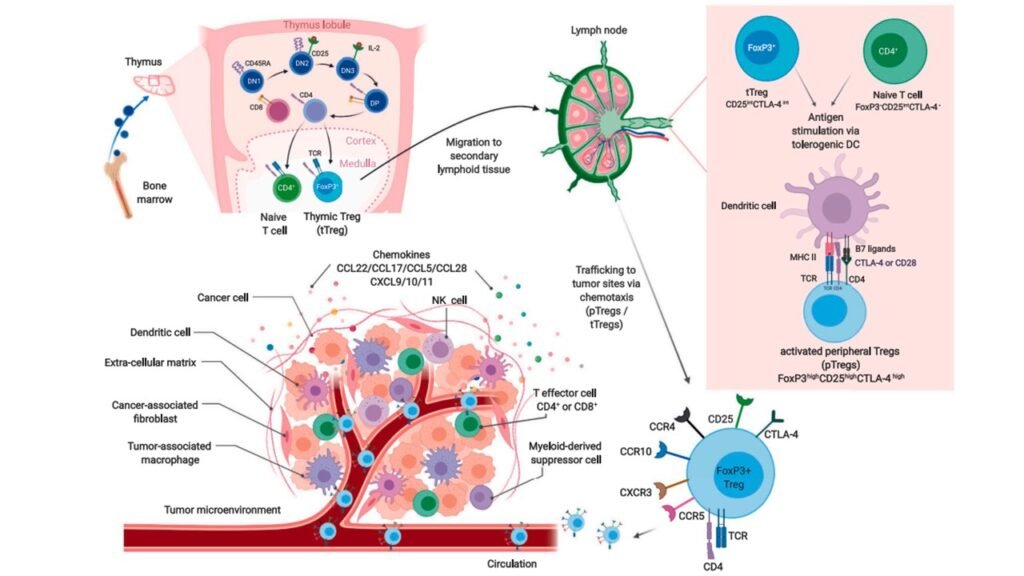
Hệ miễn dịch cơ thể người chúng ta được sản sinh từ tế bào gốc tủy xương, bao gồm nhiều loại tế bào với chức năng tiêu diệt các loại vi khuẩn, vi rút gây hại cho cơ thể, thậm chí là cả các tế bào sinh sản bất thường, gọi là ung thư. Các bạn có thể đọc thêm bài viết Nguồn gốc ung thư và vai trò của hệ miễn dịch để biết thêm. Trong số các loại tế bào miễn dịch, tế bào T là một trong những “thành viên chủ chốt” có vai trò nhận diện và tiêu diệt “kẻ thù”. Dựa vào chức năng, tế bào T có thể được chia thành nhiều nhóm nhỏ như T hỗ trợ ( T CD4⁺) và T CD8⁺ (T độc).
Tế bào T điều hòa (T regulatory, Treg) là một nhóm tế bào thuộc tế bào T CD4⁺, thường gây ức chế miễn dịch (là tình trạng làm giảm hoặc hạn chế hoạt động của hệ miễn dịch) và có đặc trưng biểu hiện yếu tố điều hòa gọi là FoxP3 (Forkhead box protein 3). FoxP3 đóng vai trò quan trọng trong biệt hóa và phát triển của tế bào T điều hòa (Treg). Tế bào Treg được phát hiện đầu tiên từ nghiên cứu của nhóm giáo sư Sakaguchi, là nhà khoa học nhận giải Nobel Y học năm nay. Trong bài nghiên cứu, nhóm tác giả xác định rằng tế bào Treg có vai trò quan trọng trong việc duy trì khả năng tự dung nạp (self-tolerance, là khả năng phân biệt các tế bào quen và lạ, để hệ miễn dịch nhận biết và không tấn công tế bào của chính cơ thể mình) và ngăn ngừa bệnh tự miễn.
Tế bào CD4⁺FoxP3⁺ Treg ban đầu được sản xuất ở tủy xương, sau đó phát triển và biệt hóa ở tuyến ức gọi là tế bào T điều hòa có nguồn gốc tuyến ức (tTreg, thymus derived Treg). Bên cạnh đó, FoxP3⁺ Treg có thể biệt hóa từ tế bào T CD4+ trinh nguyên (“naive”) khi nhận diện kháng nguyên hoặc trong điều kiện có các cytokine nhất định ở mô ngoại biên, được gọi là tế bào T điều hòa có nguồn gốc ngoại biên (pTreg, peripheral Treg). Bên cạnh pTreg với FoxP3+ còn có pTreg FoxP3-, bao gồm các phân nhóm là T điều hòa típ 1 (Tr1, type 1 T regulatory cell) và T hỗ trợ 3 (Th3, T helper 3 cell), hai nhóm tế bào này cũng liên quan tới dung nạp miễn dịch.
Theo nhiều nghiên cứu gần đây cho thấy, tăng lượng Treg FoxP3⁺ trong vi môi trường khối u (tumor microenvironment) có liên quan tới tiên lượng của bệnh nhân ung thư.
Cơ chế tích tụ Treg và tiên lượng bệnh ung thư
Trên bề mặt tế bào T điều hòa (tTreg và pTreg) có các thụ thể chemokine, và các tế bào Treg sẽ di chuyển tới vị trí khối u nhờ vào các tín hiệu của chemokine phát ra từ khối u. Các tế bào khối u và tế bào miễn dịch liên quan tới khối u sẽ giải phóng các loại chemokine như CCL17, CCL22, CCL5, CCL6 hoặc CCL28, tùy thuộc vào loại khối u và vị trí khối u, để thu hút các Treg đã hoạt hóa có các thụ thể chemokine như CCR4, CCR5, CCR10 và CXCR3 đi từ môi trường lympho thứ cấp vào vi môi trường khối u. Tại vi môi trường khối u, các tế bào hình sao (dendritic cell) liên quan tới dung nạp miễn dịch cùng với các yếu tố có nguồn gốc khối u cũng kích hoạt thêm Treg qua quá trình trình diện kháng nguyên, trong trường hợp này Treg cũng tăng biểu hiện của CD25 và FoxP3. Ngoài ra, tế bào ung thư cũng có thể chuyển tế bào hình sao chưa trưởng thành tại vi môi trường khối u thành tế bào sản xuất TGF-β. TGF-β lại là chất điều hòa thiết yếu để biệt hóa và kéo dài thời gian sống của Treg. Tóm lại, hiện tượng tích lũy Treg FoxP3⁺ tại vi môi trường khối u có thể xảy ra do nhiều nguyên nhân: tTreg/pTreg di chuyển tới u nhờ hóa ứng động, tăng Treg do yếu tố u (TGF-β và IL-10), hoặc biệt hóa từ tế bào CD4⁺ trinh nguyên.
Trong vi môi trường khối u, Treg được hoạt hóa cao, gây ức chế miễn dịch mạnh và biểu hiện yếu tố FoxP3 cao. Treg ức chế hoạt động của một số tế bào miễn dịch như tế bào T sát thủ (Teff, T effector), tế bào giết tự nhiên (NK, natural killer), bạch cầu đơn nhân/đại thực bào (monocyte/macrophage) và tế bào trình diện kháng nguyên (antigen-presenting cell) qua nhiều cơ chế khác nhau, cuối cùng dẫn đến chết tế bào theo chương trình (apoptosis) và ức chế hoạt động và tăng sinh của Teff.
Ở người khỏe mạnh, Treg chiếm khoảng 5-10% tổng số tế bào CD4⁺ trong tuần hoàn. Tuy nhiên, ở những bệnh nhân mắc ung thư như ung thư phổi, buồng trứng, dạ dày và melanoma, Treg lại chiếm lượng lớn đáng kể (khoảng gấp đôi so với người khỏe mạnh) trong tổng số tế bào CD4⁺ ở máu ngoại biên.
Trong ung thư, đặc biệt là ung thư dạng rắn, tỉ lệ tế bào lympho đi vào khối u là một trong những giá trị quan trọng nhất, phản ánh khả năng đáp ứng miễn dịch của cơ thể với ung thư đồng thời là dấu chỉ tiên đoán đáp ứng lâm sàng với các phương pháp điều trị ung thư. Mối liên hệ giữa tỉ lệ sống còn ở bệnh nhân và tế bào lympho đi vào khối u đã được mô tả ở trong rất nhiều nghiên cứu với các loại ung thư khác nhau. Ví dụ như tăng tỉ lệ tế bào T CD8⁺ đi vào khối u có liên quan tới việc tăng đáp ứng kháng u, đồng thời cho tiên lượng tốt hơn ở bệnh nhân. Tuy nhiên, tỉ lệ tế bào Treg FoxP3⁺: T CD8⁺ cao trong vi môi trường khối u lại là một trong những yếu tố làm tăng tiến triển của khối u và ức chế miễn dịch ở bệnh nhân. Thống kê cho thấy, trong các trường hợp điển hình như ung thư phổi, ung thư thận, ung thư dạ dày, ung thư vú, ung thư buồng trứng, nếu bệnh nhân có nhiều Treg FoxP3⁺ tích tụ bên trong khối u sẽ liên quan đến kết quả điều trị kém hơn và tỷ lệ sống còn ngắn hơn. Bên cạnh đó, Treg FoxP3⁺ còn chỉ ra nguy cơ kháng lại của khối u với một số phương pháp điều trị miễn dịch (như thuốc ức chế điểm kiểm soát miễn dịch), dẫn tới ung thư tiến triển và tiên lượng lâm sàng kém. Tuy nhiên, cũng có nhiều báo cáo chỉ ra rằng ở một số ít loại ung thư, điển hình như ung thư đại trực tràng, ung thư đầu cổ, việc có nhiều Treg FoxP3⁺ lại có tiên lượng bệnh tốt hơn và tỉ lệ sống sót cao hơn. Tóm lại, vấn đề liệu Treg FoxP3⁺ mang lại ý nghĩa tích cực hay tiêu cực đến tình trạng bệnh vẫn còn đang tranh cãi do phụ thuộc vào nhiều yếu tố như loại ung thư, giai đoạn bệnh và đặc điểm phân tử của khối u.
Hướng nghiên cứu điều trị nhắm đến Treg FoxP3⁺
Treg có nhiều cơ chế khác nhau để thúc đẩy ung thư hình thành và ức chế miễn dịch, dẫn tới việc chống lại một số phương pháp điều trị ung thư. Do đó, các phương pháp nhắm tới cơ chế ức chế miễn dịch điều hòa bởi Treg có thể giúp cải thiện kết cục của bệnh nhân ung thư, nhất là khi kết hợp với các liệu pháp miễn dịch như ức chế điểm kiểm soát miễn dịch (immune checkpoint inhibitor).
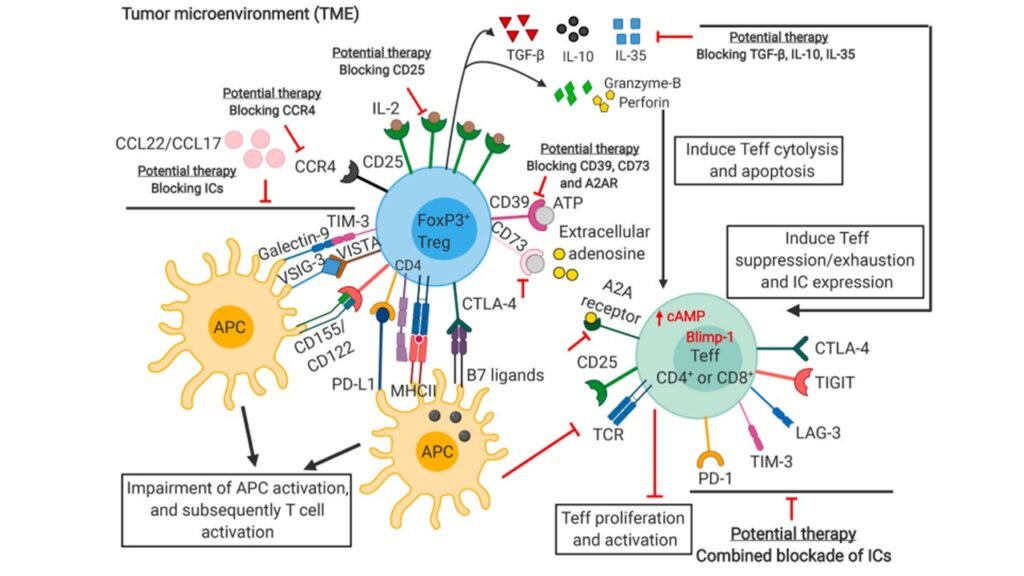
Sơ đồ trên minh họa các cơ chế mà Treg là trung gian ức chế miễn dịch trong vi môi trường khối u và thúc đẩy sinh u. Ví dụ như các tế bào Treg CCR4⁺ được chiêu mộ đến khối u qua gradient hóa hướng động từ các chemokine CCL17/CCL22. Ức chế CCR4⁺ sẽ ức chế khả năng tích tụ của Treg trong vi môi trường khối u. Ví dụ thứ hai là các tế bào Treg FoxP3⁺ có khả năng ức chế miễn dịch cao sẽ giải phóng granzyme B và perforin, hai chết này sẽ tác động lên Teff, gây ra hiện tượng chết theo chương trình (apoptosis) và ly giải tế bào (cytolysis), hiện tại vẫn chưa có điều trị tiềm năng cho cơ chế ức chế miễn dịch này. Bên cạnh đó Treg còn giải phóng ra TGF-β, IL-10 và IL-35 gây ức chế chức năng của Teff. Do đó, một phương pháp tiềm năng đang được phát triển là ức chế TGF-β, IL-10 và IL-35, từ đó tăng cường hoạt động của Teff.
Nhìn chung, hướng điều trị nhắm đến Tregs có thể chia làm các phân nhóm sau:
Nhắm vào các dấu ấn bề mặt của Treg
Mục tiêu là nhắm vào các protein cụ thể trên bề mặt tế bào Treg để tiêu diệt hoặc ngăn Treg hoạt động.
- Nhắm vào CD25: Sử dụng kháng thể để chặn CD25. Đây là thụ thể mà các tế bào Treg dùng để “đánh cắp” IL-2 (một dạng “thức ăn” quan trọng) từ các tế bào T sát thủ (Teff).
- Nhắm vào Thụ thể Chemokine (như CCR4): Các khối u tiết ra hóa chất (chemokine) để gọi Treg đến. Bằng cách chặn thụ thể của Treg (như CCR4), chúng ta có thể ngăn chúng di chuyển đến khối u. Hiện nay các nhà khoa học cũng đã phát triển một kháng thể nhắm vào CCR4 có tên mogamulizmab và ghi nhận hiệu quả của loại kháng thể này trên melanoma.
Vô hiệu hóa “Công tắc tổng” của Treg
- Nhắm vào FoxP3: FoxP3 là “công tắc tổng” giúp Treg hoạt động. Các nhà khoa học đang nghiên cứu các chất điều hòa biểu sinh (epigenetic modifier) để làm mất ổn định FoxP3, khiến tế bào Treg ngừng hoạt động. Phương pháp này được cho là đặc hiệu hơn so với nhắm vào CD25.
- Nhắm vào con đường tín hiệu PI3K: Con đường này rất quan trọng cho sự sống, chức năng và sự ổn định của Treg. Việc ức chế con đường PI3K có thể làm giảm sự tăng sinh của Treg và hoạt động tốt khi kết hợp với các thuốc anti-PD-1.
Chặn các “Vũ khí” Ức chế của Treg
Đây là cách tước đi vũ khí mà Treg sử dụng để “ra lệnh” cho các tế bào miễn dịch khác dừng lại.
- Chặn các Cytokine Ức chế: Phát triển các loại thuốc ngăn chặn các tín hiệu “dừng” mà Treg tiết ra, bao gồm TGF-β, IL-10, và IL-35.
- Chặn Con đường Adenosine: Treg sử dụng hai enzyme là CD39 và CD73 để tạo ra adenosine. Adenosine ức chế chức năng của các tế bào T sát thủ. Hiện nay có các liệu pháp đang được phát triển để ức chế CD39, CD73, hoặc thụ thể của adenosine (A2AR).
- Chặn các Điểm kiểm soát Miễn dịch (ICs, immune checkpoints): Bản thân các tế bào Treg cũng biểu hiện nhiều ICs. Hướng nghiên cứu hiện nay là phong tỏa các ICs mới phát hiện (như LAG-3, VISTA, TIM-3, TIGIT) kết hợp cùng với các thuốc anti-PD-1 hoặc anti-CTLA-4 hiện có để tăng hiệu quả chống lại việc kháng thuốc.
Mặc dù còn nhiều tranh cãi về vai trò của Treg, hầu hết bằng chứng đều cho thấy tầm quan trọng của Treg FoxP3+ trong chiến lược điều trị ung thư. Quan trọng nhất, việc kết hợp các loại thuốc nhắm vào Treg cùng với thuốc ức chế điểm kiểm soát miễn dịch có thể giúp bệnh nhân vượt qua tình trạng kháng thuốc và cải thiện đáng kể khả năng tiêu diệt khối u.
Tài liệu tham khảo
Saleh, R., & Elkord, E. (2020). FoxP3+ T regulatory cells in cancer: Prognostic biomarkers and therapeutic targets. Cancer letters, 490, 174–185. https://doi.org/10.1016/j.canlet.2020.07.022
Togashi, Y., Shitara, K., & Nishikawa, H. (2019). Regulatory T cells in cancer immunosuppression – implications for anticancer therapy. Nature reviews. Clinical oncology, 16(6), 356–371. https://doi.org/10.1038/s41571-019-0175-7
Chịu trách nhiệm nội dung:
TS. BS. Trần Thụy Hương Quỳnh. Đại học Y khoa Kansai, Osaka, Nhật Bản
Góp ý nội dung:
TS. Nguyễn Hồng Vũ. Viện nghiên cứu City of Hope, California, USA.
TS. Trịnh Vạn Ngữ, MD Anderson Cancer Center, Texas, USA.
Lần cuối chỉnh sửa khoa học: 20/11/2025


