Giải Nobel Y học năm nay đã trao cho ba nhà khoa học đã có công phát hiện ra cơ chế điều hòa miễn dịch. Cơ thể con người chúng ta có một hệ miễn dịch bao gồm nhiều loại tế bào được sản sinh ra từ tế bào gốc nằm trong tủy xương. Sự phối hợp nhịp nhàng của các tế bào này giúp chúng ta loại trừ các tác nhân gây hại cho cơ thể như vi khuẩn, virus hoặc các tế bào bất thường, bao gồm cả tế bào đột biến có nguy cơ gây ung thư. Trong các loại tế bào miễn dịch thì tế bào T (T cell) đóng vai trò quan trọng cốt lõi trong việc nhận diện đặc hiệu và tiêu diệt hiệu quả các tế bào gây bệnh. Tuy nhiên, nếu các tế bào T này hoạt động quá mức cần thiết thì có thể giết các tế bào lành của cơ thể gây ra những căn bệnh tự miễn như bệnh tiểu đường loại 1, bệnh lupus, viêm khớp dạng thấp (rheumatoid arthritis) và bệnh đa xơ cứng (multiple sclerosis).
Hiểu được cơ chế điều hòa của hệ miễn dịch lên tế bào T là nội dung của giải Nobel Y học năm nay, trao cho ba nhà khoa học đã có công phát hiện ra cơ chế điều hòa miễn dịch, giúp giải thích tại sao hệ miễn dịch của chúng ta không tấn công tế bào của chính cơ thể.
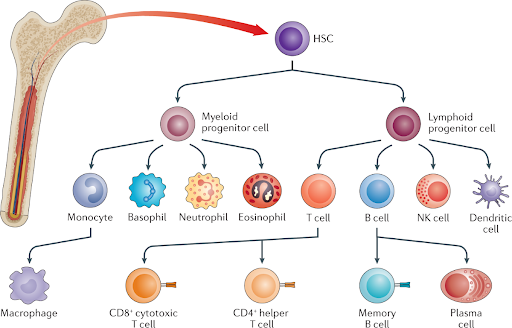
Nguồn: Nature Reviews Materials volume 4, pages 355–378 (2019)
Ba nhà khoa học được trao giải Nobel Y học năm nay đó là:
- TS. Mary E. Brunkow, đang làm việc ở Institute for Systems Biology, Seattle, USA.
- TS. Fred Ramsdell, đang làm việc ở công ty Sonoma Biotherapeutics, San Francisco, USA
- TS. Shimon Sakaguchi, đang làm việc ở Osaka University, Osaka, Japan

Nguồn: https://www.nature.com/articles/d41586-025-03193-3
Quá trình khám phá các tế bào T có vai trò điều hòa
Năm 1995, TS. Shimon Sakaguchi và các đồng nghiệp đã phát hiện ra một loại tế bào T chưa được biết đến trước đó, được gọi là tế bào T điều hòa (regulatory T cells, viết tắt là Treg). Những tế bào này khá hiếm, chỉ chiếm 1–2% tổng số tế bào T nhưng rất hiệu quả trong việc “giữ trật tự mọi thứ”, đóng vai trò như một cái “thắng” trong xe, giúp kìm hãm và ngăn không cho hệ miễn dịch phản ứng quá mức. Chúng có thể “tắt toàn bộ phản ứng” miễn dịch và làm giảm viêm rất hiệu quả.
Nhóm nghiên cứu của TS. Sakaguchi đã chứng minh rằng những con chuột thiếu các tế bào này phát triển các bệnh tự miễn ở tuyến giáp, tuyến tụy và các cơ quan khác, và việc cung cấp cho chúng các tế bào T điều hòa giúp ngăn chặn tiến triển của bệnh. Nhưng họ vẫn chưa rõ cơ chế phân tử nào trong tế bào làm được điều này!
Đến năm 2001, TS. Mary Brunkow và TS. Fred Ramsdell phát hiện một đột biến trong gen Foxp3 gây ra bệnh tự miễn ở chuột. Nghiên cứu trên gene Foxp3 tương đương ở người, họ đã chứng minh một cơ chế tương tự, đột biến gene này sẽ dẫn đến sự mất kiểm soát của tế bào T, chúng có thể tấn công các tế bào lành của cơ thể và gây các bệnh tự miễn.
Dựa trên các phát hiện của TS. Mary and Fred, các nghiên cứu tiếp theo của TS. Sakaguchi và các đồng nghiệp vào năm 2003 cho thấy Foxp3 được biểu hiện đặc hiệu ở tế bào T điều hòa và là cần thiết cho sự phát triển của chúng. Nói cách khác, Foxp3 là chìa khóa quan trọng để hiểu về cơ chế hoạt động của nhóm tế bào Treg để nghiên cứu ứng dụng chúng tốt hơn.
Ứng dụng trong điều trị bệnh tự miễn
Việc hiểu rõ cơ chế của tế bào Treg đã mở ra hướng nghiên cứu rộng lớn để điều trị bệnh cho những người mắc một số bệnh tự miễn, bao gồm tiểu đường type 1, lupus, viêm khớp dạng thấp và đa xơ cứng. Trong cơ thể những người bệnh này thường có quá ít tế bào Treg trong máu hoặc những tế bào này không hoạt động đúng chức năng mà chúng cần có. Hiện nay, có khoảng 200 nghiên cứu lâm sàng đang được tiến hành để tìm hướng điều trị dựa trên các nghiên cứu về tế bào Treg.
Một số công ty dược phẩm hàng đầu, bao gồm Eli Lilly ở Indianapolis, bang Indiana, và Celgene có trụ sở tại Summit, bang New Jersey, đã đầu tư vào các loại thuốc mô phỏng hoạt động của tế bào Treg. Hiện nay, các liệu pháp nhằm điều trị bệnh tiểu đường type 1, viêm gan tự miễn và phản ứng thải loại sau khi ghép tạng (graft-versus-host disease) đang trong giai đoạn thử nghiệm lâm sàng.
Năm ngoái, công ty Sonoma Biotherapeutics của TS. Fred Ramsdell đã khởi động hai thử nghiệm lâm sàng để kiểm tra hai loại thuốc được tạo ra từ chính tế bào Treg của bệnh nhân trưởng thành mắc viêm khớp dạng thấp và một tình trạng mãn tính gây nổi các nốt đau dưới da.
Vai trò trong nghiên cứu và điều trị ung thư
Nếu Foxp3 giúp các tế bào lành của cơ thể chúng ta an toàn trước những phản ứng quá mức của hệ miễn dịch, thì trong ung thư nó cũng là một điểm nhấn quan trọng, vì đây là con đường mà nhiều tế bào ung thư thường “lợi dụng” để tránh bị tiêu diệt bởi tế bào miễn dịch của cơ thể.
Trong ung thư, Foxp3 và các tế bào Treg mang vai trò hai mặt: chúng có thể bảo vệ cơ thể khỏi viêm mạn tính – yếu tố thúc đẩy sự hình thành ung thư – nhưng đồng thời cũng có thể giúp khối u “trốn thoát” hệ miễn dịch bằng cách ức chế hoạt động của các tế bào miễn dịch. Do vậy, trong nhiều loại ung thư, sự tích tụ của tế bào Treg có biểu hiện gene Foxp3 cao trong vi môi trường khối u thường liên quan đến tiên lượng xấu do ức chế miễn dịch chống u.
Tuy nhiên, trong một số loại ung thư, chẳng hạn ung thư đại trực tràng, ung thư vú hoặc ung thư đầu cổ, mức Foxp3 cao (tức là nhiều tế bào T điều hòa – Treg hoặc tế bào u có biểu hiện Foxp3) lại liên quan đến tiên lượng tốt. Nguyên nhân chính nằm ở vai trò chống viêm và điều hòa miễn dịch của Foxp3. Cụ thể, viêm mạn tính trong mô quanh khối u có thể thúc đẩy đột biến DNA, tăng sinh mạch máu và di căn. Khi có nhiều tế bào Treg mang Foxp3, chúng giúp giảm phản ứng viêm quá mức, ổn định vi môi trường mô, và hạn chế tổn thương thứ phát do miễn dịch. Kết quả là sự tiến triển của khối u chậm lại và tiên lượng sống cải thiện.
Đọc thêm: Liệu pháp miễn dịch trong điều trị ung thư
Kết luận
Giải Nobel về Y Học năm nay đã vinh danh các nhà khoa học đã có những đóng góp lớn cho những khám phá giúp đặt nền móng cho sự hiểu biết của con người về cơ chế “điều hòa” trong hệ miễn dịch. Những kiến thức này đã và đang thúc đẩy sự phát triển của các phương pháp điều trị y tế cho các bệnh tự miễn, nâng cao tỷ lệ thành công trong cấy ghép tạng và tối ưu hóa trong điều trị ung thư.
Tài liệu tham khảo
- Sakaguchi, S., Sakaguchi, N., Asano, M., Itoh, M. & Toda, M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor α-chains (CD25): breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J. Immunol. 155, 1151–1164 (1995).
- Brunkow, M. E. et al. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat. Genet. 27, 68–73 (2001).
- Ramsdell, F. & Ziegler, S. F. FOXP3 and scurfy: how it all began. Nat. Rev. Immunol. 14, 343–349 (2014).
- Hori, S., Nomura, T. & Sakaguchi, S. Control of regulatory T cell development by the transcription factor Foxp3. Science 299, 1057–1061 (2003).
- Josefowicz, S. Z., Lu, L. F. & Rudensky, A. Y. Regulatory T cells: mechanisms of differentiation and function. Annu. Rev. Immunol. 30, 531–564 (2012).
- Wing, K. & Sakaguchi, S. Regulatory T cells exert checks and balances on self-tolerance and autoimmunity. Nat. Immunol. 11, 7–13 (2010).
- Miyara, M. & Sakaguchi, S. Human FoxP3+ regulatory T cells: their knowns and unknowns. Immunol. Cell Biol. 89, 346–351 (2011).
Tanaka, A. & Sakaguchi, S. Regulatory T cells in cancer immunotherapy. Cell Res. 27, 109–118 (2017). - Togashi, Y., Shitara, K. & Nishikawa, H. Regulatory T cells in cancer immunosuppression — implications for anticancer therapy. Nat. Rev. Clin. Oncol. 16, 356–371 (2019).
Sakaguchi, S. et al. The biology of Foxp3+ regulatory T cells and their therapeutic potential. Nat. Rev. Immunol. 23, 295–312 (2023).


